引用本文: 陳思, 張偉, 寧允葉, 董宇超, 李強, 白沖. 尼龍刷刮擦機械損傷建立大鼠良性氣管狹窄模型的研究. 中國呼吸與危重監護雜志, 2019, 18(3): 265-270. doi: 10.7507/1671-6205.201903073 復制
良性中央氣道狹窄是呼吸系統的常見疾病。近年來,隨著危重癥醫學的進步與呼吸支持技術的發展,以及肺移植等手術的開展和普及,良性氣道狹窄的發生率呈增高趨勢。而良性氣道狹窄的治療手段及療效均有限,再狹窄率高且需要定期氣管鏡隨訪,因此仍是介入呼吸病學領域的一項挑戰[1]。建立一種簡易、可靠的良性氣道狹窄動物模型對于研究發病機制、治療干預以及評估療效預后等尤為重要。由于操作便利、發育迅速、繁殖力強、價格低廉等優勢,并且在大多數實驗室中都很容易獲得,基于鼠的動物模型一直是醫學研究領域的“主力”。然而,受到動物大小和氣道口徑等因素的限制,使得該動物未能在良性氣道狹窄研究領域被廣泛應用。也有一些研究人員堅持利用小鼠模型,以非原位的方法研究氣管的生物學功能[2]。我們建立了一種新型的基于大鼠的良性氣管狹窄原位模型,該模型模擬臨床上常見的繼發于插管或氣管切開等的黏膜機械損傷,可作為良性氣道狹窄致病機制研究和新藥療效探索的可靠實驗載體。
1 材料與方法
1.1 實驗動物及分組
本研究通過第二軍醫大學長海醫院動物倫理委員會同意,所有操作符合實驗動物管理條例。實驗選用 Sprague Dawley 大鼠 35 只(長海醫院實驗中心動物房提供),雄性,220~300 g。實驗前適應性飼養 1 周,觀察動物有無異常表現。按隨機數字法將 20 只 SD 大鼠分為模型組(10 只)和偽手術對照組(10 只),觀察生存情況,測算并比較狹窄度;另外 15 只大鼠進行實驗造模,于造模后不同時間點(第 0、2、4、6、8 d)獲取氣管組織觀察病理改變。
1.2 儀器與設備
3% 戊巴比妥鈉溶液(上海試劑二廠)、無菌注射器(美國 BD 公司)、小動物手術器械(德國 Roboz 公司)、3M VetbondTM組織黏膠(美國 3M 公司)、5% 碘伏棉球、75% 的酒精棉球、滅菌干棉球若干(長海醫院呼吸科提供)、防護手套、脫毛膏、1.5 mm 直徑硬質尼龍刷、新鮮配制的 4% 多聚甲醛溶液、包埋盒、石蠟、二甲苯、100% 酒精、雙蒸水、水浴鍋、切片機、載玻片、蓋玻片、中性樹膠、蘇木精-伊紅(hematoxylin-eosin,HE)染色試劑盒、Masson 染色試劑盒等。
1.3 方法
1.3.1 實驗方法
實驗前所有動物禁食 6~8 h,3% 戊巴比妥鈉(0.1~0.2 ml/100 g)經腹腔注射麻醉。將 SD 大鼠仰臥固定,頸前區用脫毛膏被毛,以 0.5% 碘伏消毒,作長約 3 cm 的頸前區正中切口,鈍性分離頜下腺及氣管旁肌肉,左右兩側分別以彎頭止血鉗牽拉氣管旁肌肉以暴露喉和氣管,在距環狀軟骨 0.4 cm 處橫向切開氣管,切開 2/3 周徑。對照組進行以上操作后即進行后續縫合處理;模型組從切口處向遠端伸入 1.5 mm 直徑硬質尼龍刷(圖 1a),來回刮刷 10 次以刮除黏膜,摩擦區域長約 1 cm(圖 1b),若操作過程出現氣管內出血,可用鑷子鉗取少量止血棉球深入管腔壓迫止血。兩組大鼠均用 6-0 帶線縫針進行氣管間斷縫合。松開止血鉗,將氣管旁肌肉歸位,用 4-0 縫線逐層縫合肌肉、頜下腺、皮下組織。最后,用組織膠(3M VetbondTM)粘合皮膚。所有動物術后置于加熱毯,待麻醉蘇醒后放歸飼養環境。
 圖1
造模用尼龍刷和刮擦示意圖
圖1
造模用尼龍刷和刮擦示意圖
a. 專用 1.5 mm 直徑硬質尼龍刷;b. 手術操作中刮擦示意圖
1.3.2 觀察指標
(1)一般情況:術后每天觀察實驗大鼠有無氣短、喘息、呼吸困難等癥狀,以及精神狀況、飲食情況、活動情況,記錄大鼠造模后的生存時間。
(2)病理學改變:動物自然死亡或處死后,取造模段氣管組織橫切標本進行病例分析,了解黏膜損傷及肉芽組織增生情況。上述造模與對照組 SD 大鼠自然死亡或 CO2 處死箱安樂死后,在頸前區正中作一長約 5 cm 的切口,鈍性分離頜下腺及氣管旁肌肉,暴露喉和氣管,用眼科剪截取環狀軟骨下 0.4~1.4 cm 的氣管段(位置相當于模型組的造模段氣管),將氣管組織沿著氣管軟骨環截為若干長約 0.3 cm 的氣管段,放入預先標記好的包埋盒,置于 4% 多聚甲醛溶液。取材要迅速,避免組織在空氣中暴露過長時間。夾取組織時,避免將鑷子伸入氣管管腔,破壞管腔內結構。組織固定后進行包埋、切片、HE 染色及 Masson 染色,最后顯微鏡下觀察。
(3)狹窄度測算與比較:參考 Nakagishi 等[3]的方法,狹窄度的計算公式為(1-s/S)×100%。其中,s 為發生狹窄時候氣管通氣腔的面積,s=π[(d1+d2)/2]2,d1 為通氣腔內最長徑,d2 為通氣腔內最短徑;S 為軟骨環圍成的環形面積,S=π[(D1+D2)/2]2,D1 為軟骨圍成環的最長徑,D2 為最短徑。
1.4 統計學方法
應用 Graphpad Prism 7 軟件進行統計分析和制圖。所有計量資料均以均數±標準差( ±s)表示,組間比較采用 One way ANOVA 分析,P<0.05 為差異有統計學意義。生存曲線的比較用 Log-rank 檢驗,P<0.05 為差異有統計學意義。
±s)表示,組間比較采用 One way ANOVA 分析,P<0.05 為差異有統計學意義。生存曲線的比較用 Log-rank 檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 實驗大鼠的基本情況
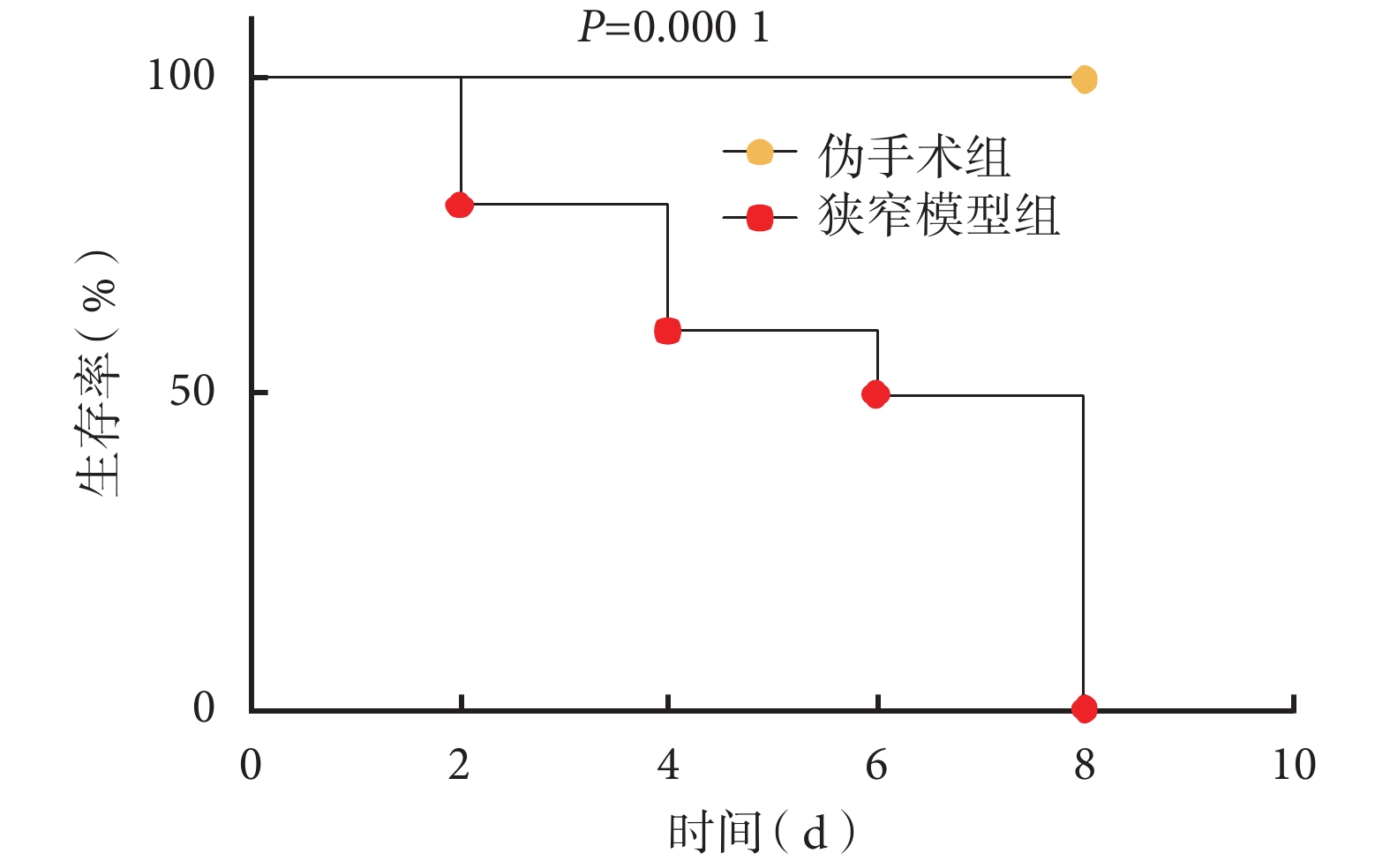
偽手術組 SD 大鼠(10 只)術后精神狀態、活動狀態良好;飲水、飲食正常;未觀察到氣促、呼吸困難等癥狀;術后第 8 d 存活率為 100%。狹窄模型組(10 只)術后精神萎靡,活動度降低,飲水、飲食均減少;1 只大鼠于術后 2 d 死亡,死因為黏液栓樣物質阻塞氣道;術后第 3 d 可見該組動物出現氣促、憋喘癥狀;第 4 d 見實驗動物蝸居籠具角落,可見呼吸幅度顯著增加、呼吸困難、可聞及喘鳴音;術后第 6 d 死亡率 50%,第 8 d 死亡率 100%(圖 2);獲取氣管組織時肉眼可見管腔內新生肉芽組織及黏液栓樣物質。經 Log-rank 檢驗,兩組生存情況差異有統計學意義(P=0.000 1)。
 圖2
偽手術組及狹窄模型組的生存情況比較
圖2
偽手術組及狹窄模型組的生存情況比較
2.2 狹窄度
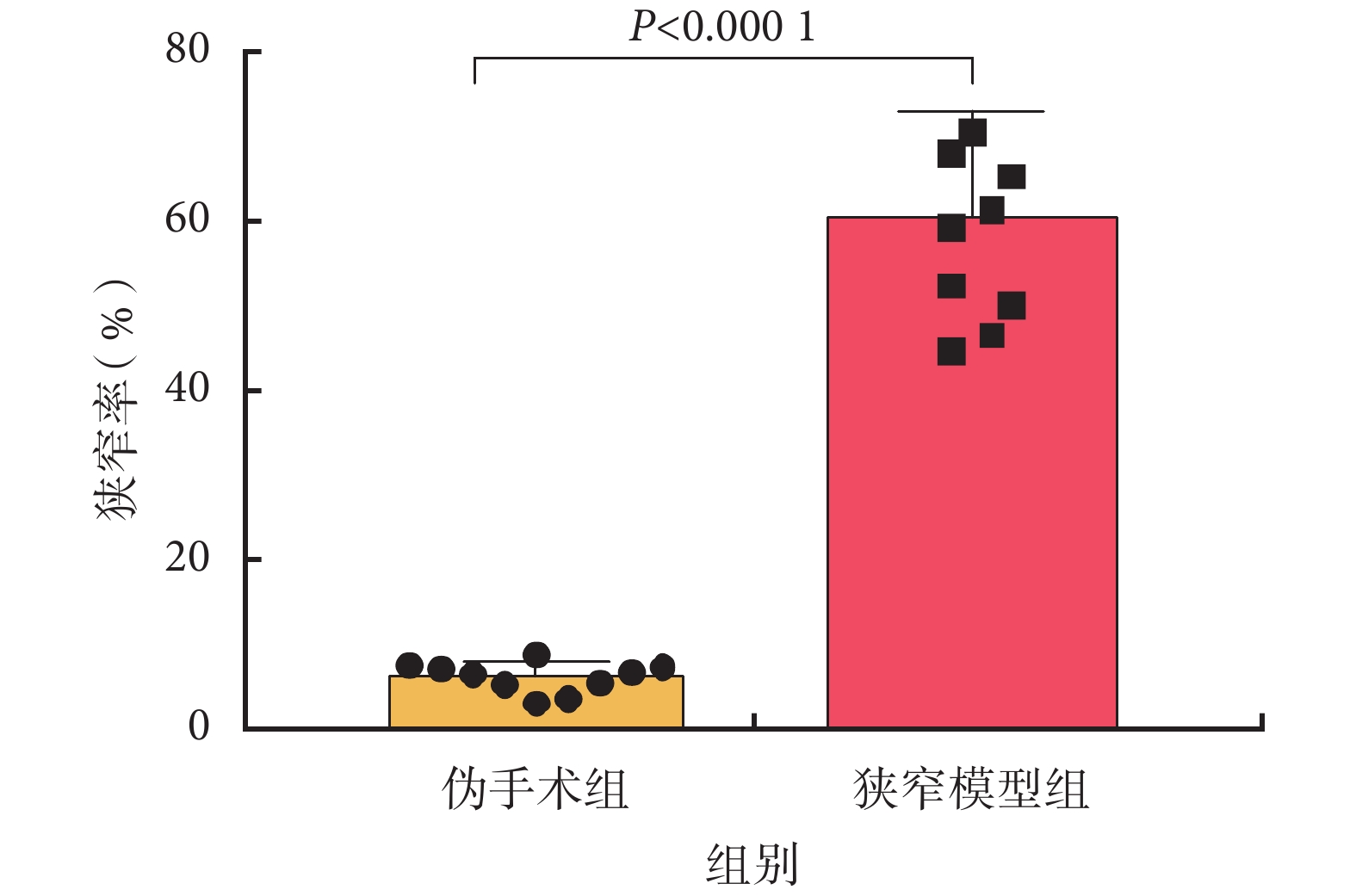
偽手術組的狹窄度為(6.12±1.78)%,狹窄模型組的狹窄度為(60.28±12.56)%,兩組之間的狹窄度差異有統計學意義(P<0.000 1),結果詳見圖 3。
 圖3
偽手術組與狹窄模型組的氣管狹窄度比較
圖3
偽手術組與狹窄模型組的氣管狹窄度比較
2.3 病理改變
2.3.1 偽手術組及狹窄模型組大鼠的氣管截面 HE 染色
偽手術組(圖 4a-c)氣道通暢,管腔內上皮組織/黏膜完整而形態規整,纖毛結構清晰可見,為假復層纖毛柱狀上皮,符合正常大氣道黏膜的特征,未發現有肉芽組織增生或狹窄。而狹窄模型組,在尼龍刷刮擦引起機械損傷的區域均出現不同程度的狹窄(圖 4d-f),可見肉芽組織增生顯著;未見上皮結構或上皮結構極度異常;可見過度增殖、排列紊亂的成纖維細胞,形態為不規則形、梭形,旋渦狀排列;膠原纖維過度沉積、新生毛細血管增多;部分區域還出現軟骨錯位、塌陷。
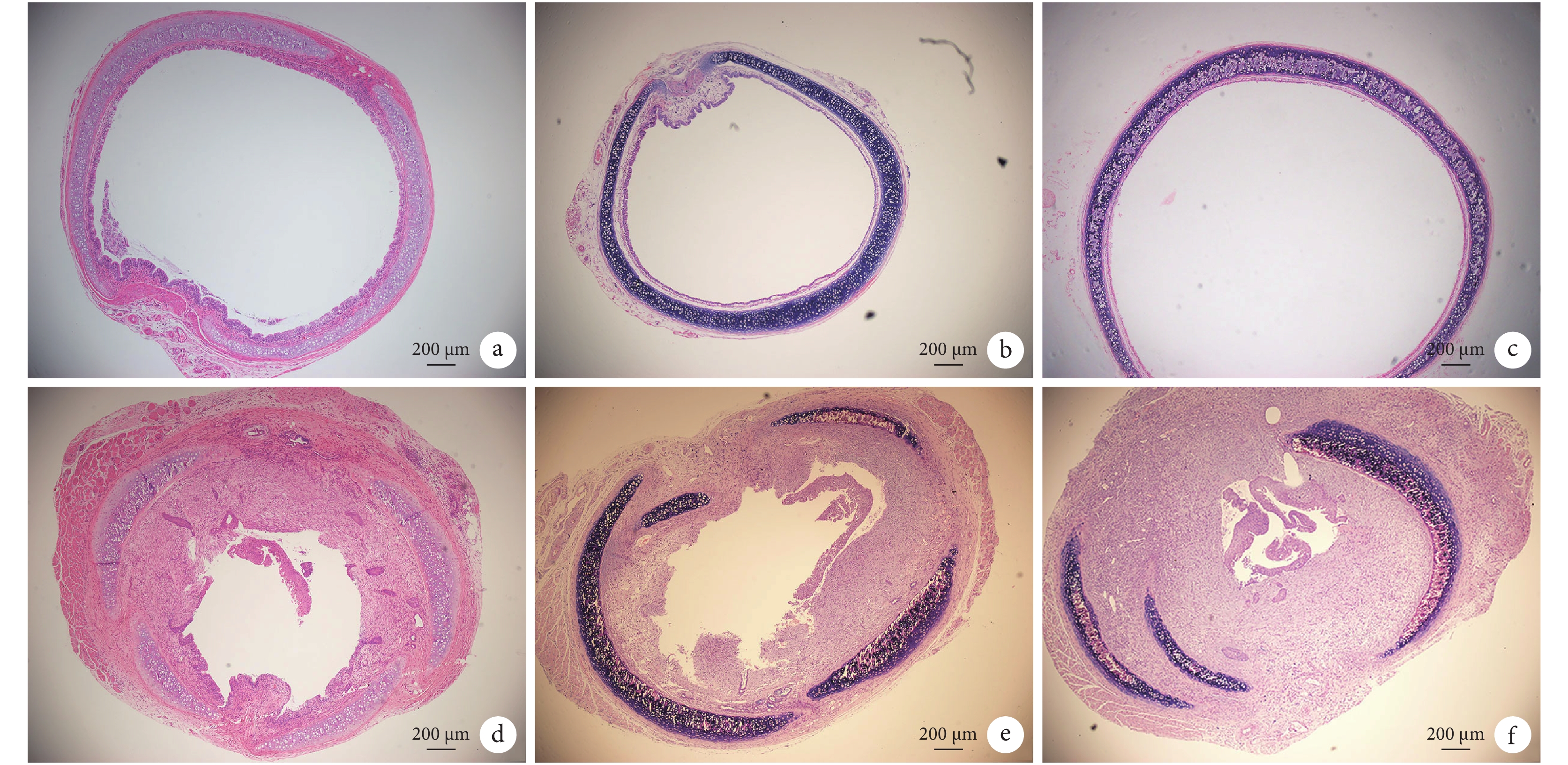 圖4
偽手術組與狹窄模型組的氣管截面病理檢查像(HE×10)
圖4
偽手術組與狹窄模型組的氣管截面病理檢查像(HE×10)
a-c. 偽手術組;d-f. 狹窄模型組。偽手術組氣管管腔通暢,上皮黏膜組織完整而光滑,纖毛結構清晰可見,未發現有肉芽組織增生或管腔狹窄。模型組機械損傷后,可見管腔顯著狹窄,狹窄成分主要為增生的肉芽組織,未見上皮結構或上皮結構極度異常
2.3.2 狹窄模型組造模后不同時間點大鼠氣管截面 HE 和 Masson 染色
結果見圖 5。損傷后第 2 d(圖 5c、d)即可觀察到肉芽組織,其間可見散在成纖維細胞及炎性細胞。成纖維細胞在第 4 d(圖 5e、f)左右呈爆發式增殖,為多突起的紡錘形或星形的扁平細胞,漩渦樣排列,胞核較大呈橢圓形;伴大量炎癥細胞浸潤。成纖維細胞于第 6 d(圖 5g、h)左右達最大量。在第 8 d(圖 5i、j)部分成纖維細胞胞體變小變狹長,細胞核變小,轉化為纖維細胞。Masson 染色結果顯示,造模后損傷部位的膠原纖維(藍色)隨著時間呈逐漸增多的趨勢。
 圖5
黏膜機械損傷后不同時間點氣管截面病理檢查像(×20)
圖5
黏膜機械損傷后不同時間點氣管截面病理檢查像(×20)
a、c、e、g、i. HE 染色;b、d、f、h、j. Masson 染色。a、b. 手術當日;c、d. 術后第 2 d;e、f. 術后第 4 d;g、h. 術后第 6 d;i、j. 術后第 8 d。手術當日氣管管腔通暢,上皮黏膜組織完整而光滑,未發現有肉芽組織增生或管腔狹窄。機械損傷后第 2 d 即可觀察到肉芽組織,其間可見散在成纖維細胞及炎性細胞,成纖維細胞在第 4 d 左右呈爆發式增殖,伴大量炎癥細胞浸潤,在第 8 d 部分成纖維細胞胞體變小變狹長,細胞核變小,轉化為纖維細胞。Masson 染色見損傷部位的成纖維細胞呈先增多后下降趨勢,損傷部位的膠原纖維隨著時間而逐漸增多
3 討論
國外氣道狹窄的病因構成中主要以肺移植及長期氣管插管或造口術后狹窄為主[1, 4]。我國既往以氣管結核居首位,占所有病因的 60% 以上;長期氣管插管或氣管造口所致氣管狹窄居第二位,約占 15.0%[5-6]。近年來,隨著危重癥醫學的發展、呼吸支持技術在危重患者救治中的廣泛運用,以及肺移植、氣道手術的開展和普及,嚴重氣道并發癥的發生率逐漸提高[7-10]。氣管插管或切開所占良性中央氣道狹窄的病因比重大大提高,或將取代結核成為首要致病因素。Myer 等[11]根據阻塞情況將氣道狹窄分為 4 度。通常患者在狹窄超過 50%,即 2 度以上狹窄后才出現相關癥狀,很多患者直到突發感染、水腫、黏液栓塞等致死性氣道阻塞時才得以診斷。有將近 10% 的良性氣道狹窄患者被漏診或誤診[12-13]。當前,良性氣道狹窄的治療手段主要為手術切除狹窄段及斷端吻合、球囊擴張、支架置入、熱消融、冷凍治療、局部絲裂霉素 C 等藥物治療、局部/全身應用類固醇激素、腔內近距離放療等[1-22],但療效均有限,再狹窄率極高且需要定期氣管鏡隨訪。因此迫切需要建立一種簡易、可靠的良性氣道狹窄動物模型,以研究其發病機制、治療干預以及評估療效預后等。
本實驗結果提示:機械損傷可引起上皮結構的破壞及肉芽組織的過度增生,尼龍刷刮擦可以成功制作獲得性良性氣道狹窄模型。氣管插管引發良性氣道狹窄的病理機制主要為長時間插管,安全氣囊對氣管壁產生機械壓迫,引起黏膜缺血、壞死,甚至引起深達軟骨的炎癥。壞死的黏膜脫落后,損傷部位容易合并病原體感染,進一步加重炎癥。損傷處的微環境中促炎因子大量釋放,炎癥細胞增多,成纖維細胞被廣泛募集并通過有絲分裂的方式大量增殖,導致成纖維細胞主導的異常修復。肉芽組織增生可于插管后數小時內開始發生[23-24],而狹窄則通常則在 5 d 之后才開始出現[25]。肉芽組織為幼稚階段的纖維結締組織,由增生的成纖維細胞以及新生薄壁的毛細血管構成,并伴有大量炎癥細胞的浸潤。炎性細胞中常以巨噬細胞為主,分泌大量轉化生長因子-β、白細胞介素-1 及腫瘤壞死因子-α,進一步刺激成纖維細胞及毛細血管的增生。在損傷修復的整個過程中,成纖維細胞發揮著舉足輕重的作用。損傷后前 3 d,成纖維細胞以有絲分裂的方式大量增殖;4~5 d 后,成纖維細胞開始合成和分泌大量的膠原纖維和基質成分,與新生毛細血管等共同形成肉芽組織填補傷口;在修復后期,表現為收縮表型—肌成纖維細胞,造成創面收縮,并通過分泌膠原酶參與修復后組織的改建引起瘢痕攣縮,最終形成瘢痕狹窄[26-30]。本實驗模擬了臨床上常見的繼發于插管或氣管切開等的黏膜機械損傷,各時間截點的大鼠氣管中成纖維細胞及膠原纖維沉積情況與文獻報道的病理病程相符,作為研究良性氣道狹窄的動物模型十分適宜。
不同的實驗目的有不同的造模方法,基本原理相仿,均以破壞黏膜為主。目前常用的制造動物氣道狹窄模型的方法有:機械損傷,包括用毛刷或者活檢鉗等刮擦、咬檢氣管黏膜,氣管內置入球囊導管、金屬支架等[31-33];化學損傷,黏膜下注射鹽酸、NaOH、酒精等[34-36];熱損傷、高頻電燒、氬氣刀、激光等[37]。這些方法可單獨使用,亦可聯合應用。良性氣道狹窄常用的造模動物有兔子[3, 38]、犬類[39]、山羊、豬等[40-41]。本模型采用 SD 大鼠,其體積較小,造模操作更加方便省時,重復性好且價格低廉。但本模型也有一定的局限性,由于大鼠氣管管腔面積基數小,造模后(無任何治療)肉芽組織在造模后第 8 d 幾乎充滿管腔,導致氣道完全閉塞、動物窒息死亡。因此,該模型僅適用于狹窄早期階段(肉芽組織增生期)的研究,不適用于瘢痕狹窄階段。
綜合以上實驗結果可以得出,尼龍刷刮擦機械損傷氣管黏膜的方式可以成功建立穩定、可靠的良性氣道狹窄急性模型。其病理進程與臨床上插管、造口等引起的良性氣道狹窄相仿,可用于良性氣道狹窄致病機制的研究和新藥療效的探索。
良性中央氣道狹窄是呼吸系統的常見疾病。近年來,隨著危重癥醫學的進步與呼吸支持技術的發展,以及肺移植等手術的開展和普及,良性氣道狹窄的發生率呈增高趨勢。而良性氣道狹窄的治療手段及療效均有限,再狹窄率高且需要定期氣管鏡隨訪,因此仍是介入呼吸病學領域的一項挑戰[1]。建立一種簡易、可靠的良性氣道狹窄動物模型對于研究發病機制、治療干預以及評估療效預后等尤為重要。由于操作便利、發育迅速、繁殖力強、價格低廉等優勢,并且在大多數實驗室中都很容易獲得,基于鼠的動物模型一直是醫學研究領域的“主力”。然而,受到動物大小和氣道口徑等因素的限制,使得該動物未能在良性氣道狹窄研究領域被廣泛應用。也有一些研究人員堅持利用小鼠模型,以非原位的方法研究氣管的生物學功能[2]。我們建立了一種新型的基于大鼠的良性氣管狹窄原位模型,該模型模擬臨床上常見的繼發于插管或氣管切開等的黏膜機械損傷,可作為良性氣道狹窄致病機制研究和新藥療效探索的可靠實驗載體。
1 材料與方法
1.1 實驗動物及分組
本研究通過第二軍醫大學長海醫院動物倫理委員會同意,所有操作符合實驗動物管理條例。實驗選用 Sprague Dawley 大鼠 35 只(長海醫院實驗中心動物房提供),雄性,220~300 g。實驗前適應性飼養 1 周,觀察動物有無異常表現。按隨機數字法將 20 只 SD 大鼠分為模型組(10 只)和偽手術對照組(10 只),觀察生存情況,測算并比較狹窄度;另外 15 只大鼠進行實驗造模,于造模后不同時間點(第 0、2、4、6、8 d)獲取氣管組織觀察病理改變。
1.2 儀器與設備
3% 戊巴比妥鈉溶液(上海試劑二廠)、無菌注射器(美國 BD 公司)、小動物手術器械(德國 Roboz 公司)、3M VetbondTM組織黏膠(美國 3M 公司)、5% 碘伏棉球、75% 的酒精棉球、滅菌干棉球若干(長海醫院呼吸科提供)、防護手套、脫毛膏、1.5 mm 直徑硬質尼龍刷、新鮮配制的 4% 多聚甲醛溶液、包埋盒、石蠟、二甲苯、100% 酒精、雙蒸水、水浴鍋、切片機、載玻片、蓋玻片、中性樹膠、蘇木精-伊紅(hematoxylin-eosin,HE)染色試劑盒、Masson 染色試劑盒等。
1.3 方法
1.3.1 實驗方法
實驗前所有動物禁食 6~8 h,3% 戊巴比妥鈉(0.1~0.2 ml/100 g)經腹腔注射麻醉。將 SD 大鼠仰臥固定,頸前區用脫毛膏被毛,以 0.5% 碘伏消毒,作長約 3 cm 的頸前區正中切口,鈍性分離頜下腺及氣管旁肌肉,左右兩側分別以彎頭止血鉗牽拉氣管旁肌肉以暴露喉和氣管,在距環狀軟骨 0.4 cm 處橫向切開氣管,切開 2/3 周徑。對照組進行以上操作后即進行后續縫合處理;模型組從切口處向遠端伸入 1.5 mm 直徑硬質尼龍刷(圖 1a),來回刮刷 10 次以刮除黏膜,摩擦區域長約 1 cm(圖 1b),若操作過程出現氣管內出血,可用鑷子鉗取少量止血棉球深入管腔壓迫止血。兩組大鼠均用 6-0 帶線縫針進行氣管間斷縫合。松開止血鉗,將氣管旁肌肉歸位,用 4-0 縫線逐層縫合肌肉、頜下腺、皮下組織。最后,用組織膠(3M VetbondTM)粘合皮膚。所有動物術后置于加熱毯,待麻醉蘇醒后放歸飼養環境。
 圖1
造模用尼龍刷和刮擦示意圖
圖1
造模用尼龍刷和刮擦示意圖
a. 專用 1.5 mm 直徑硬質尼龍刷;b. 手術操作中刮擦示意圖
1.3.2 觀察指標
(1)一般情況:術后每天觀察實驗大鼠有無氣短、喘息、呼吸困難等癥狀,以及精神狀況、飲食情況、活動情況,記錄大鼠造模后的生存時間。
(2)病理學改變:動物自然死亡或處死后,取造模段氣管組織橫切標本進行病例分析,了解黏膜損傷及肉芽組織增生情況。上述造模與對照組 SD 大鼠自然死亡或 CO2 處死箱安樂死后,在頸前區正中作一長約 5 cm 的切口,鈍性分離頜下腺及氣管旁肌肉,暴露喉和氣管,用眼科剪截取環狀軟骨下 0.4~1.4 cm 的氣管段(位置相當于模型組的造模段氣管),將氣管組織沿著氣管軟骨環截為若干長約 0.3 cm 的氣管段,放入預先標記好的包埋盒,置于 4% 多聚甲醛溶液。取材要迅速,避免組織在空氣中暴露過長時間。夾取組織時,避免將鑷子伸入氣管管腔,破壞管腔內結構。組織固定后進行包埋、切片、HE 染色及 Masson 染色,最后顯微鏡下觀察。
(3)狹窄度測算與比較:參考 Nakagishi 等[3]的方法,狹窄度的計算公式為(1-s/S)×100%。其中,s 為發生狹窄時候氣管通氣腔的面積,s=π[(d1+d2)/2]2,d1 為通氣腔內最長徑,d2 為通氣腔內最短徑;S 為軟骨環圍成的環形面積,S=π[(D1+D2)/2]2,D1 為軟骨圍成環的最長徑,D2 為最短徑。
1.4 統計學方法
應用 Graphpad Prism 7 軟件進行統計分析和制圖。所有計量資料均以均數±標準差( ±s)表示,組間比較采用 One way ANOVA 分析,P<0.05 為差異有統計學意義。生存曲線的比較用 Log-rank 檢驗,P<0.05 為差異有統計學意義。
±s)表示,組間比較采用 One way ANOVA 分析,P<0.05 為差異有統計學意義。生存曲線的比較用 Log-rank 檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 實驗大鼠的基本情況
偽手術組 SD 大鼠(10 只)術后精神狀態、活動狀態良好;飲水、飲食正常;未觀察到氣促、呼吸困難等癥狀;術后第 8 d 存活率為 100%。狹窄模型組(10 只)術后精神萎靡,活動度降低,飲水、飲食均減少;1 只大鼠于術后 2 d 死亡,死因為黏液栓樣物質阻塞氣道;術后第 3 d 可見該組動物出現氣促、憋喘癥狀;第 4 d 見實驗動物蝸居籠具角落,可見呼吸幅度顯著增加、呼吸困難、可聞及喘鳴音;術后第 6 d 死亡率 50%,第 8 d 死亡率 100%(圖 2);獲取氣管組織時肉眼可見管腔內新生肉芽組織及黏液栓樣物質。經 Log-rank 檢驗,兩組生存情況差異有統計學意義(P=0.000 1)。
 圖2
偽手術組及狹窄模型組的生存情況比較
圖2
偽手術組及狹窄模型組的生存情況比較
2.2 狹窄度
偽手術組的狹窄度為(6.12±1.78)%,狹窄模型組的狹窄度為(60.28±12.56)%,兩組之間的狹窄度差異有統計學意義(P<0.000 1),結果詳見圖 3。
 圖3
偽手術組與狹窄模型組的氣管狹窄度比較
圖3
偽手術組與狹窄模型組的氣管狹窄度比較
2.3 病理改變
2.3.1 偽手術組及狹窄模型組大鼠的氣管截面 HE 染色
偽手術組(圖 4a-c)氣道通暢,管腔內上皮組織/黏膜完整而形態規整,纖毛結構清晰可見,為假復層纖毛柱狀上皮,符合正常大氣道黏膜的特征,未發現有肉芽組織增生或狹窄。而狹窄模型組,在尼龍刷刮擦引起機械損傷的區域均出現不同程度的狹窄(圖 4d-f),可見肉芽組織增生顯著;未見上皮結構或上皮結構極度異常;可見過度增殖、排列紊亂的成纖維細胞,形態為不規則形、梭形,旋渦狀排列;膠原纖維過度沉積、新生毛細血管增多;部分區域還出現軟骨錯位、塌陷。
 圖4
偽手術組與狹窄模型組的氣管截面病理檢查像(HE×10)
圖4
偽手術組與狹窄模型組的氣管截面病理檢查像(HE×10)
a-c. 偽手術組;d-f. 狹窄模型組。偽手術組氣管管腔通暢,上皮黏膜組織完整而光滑,纖毛結構清晰可見,未發現有肉芽組織增生或管腔狹窄。模型組機械損傷后,可見管腔顯著狹窄,狹窄成分主要為增生的肉芽組織,未見上皮結構或上皮結構極度異常
2.3.2 狹窄模型組造模后不同時間點大鼠氣管截面 HE 和 Masson 染色
結果見圖 5。損傷后第 2 d(圖 5c、d)即可觀察到肉芽組織,其間可見散在成纖維細胞及炎性細胞。成纖維細胞在第 4 d(圖 5e、f)左右呈爆發式增殖,為多突起的紡錘形或星形的扁平細胞,漩渦樣排列,胞核較大呈橢圓形;伴大量炎癥細胞浸潤。成纖維細胞于第 6 d(圖 5g、h)左右達最大量。在第 8 d(圖 5i、j)部分成纖維細胞胞體變小變狹長,細胞核變小,轉化為纖維細胞。Masson 染色結果顯示,造模后損傷部位的膠原纖維(藍色)隨著時間呈逐漸增多的趨勢。
 圖5
黏膜機械損傷后不同時間點氣管截面病理檢查像(×20)
圖5
黏膜機械損傷后不同時間點氣管截面病理檢查像(×20)
a、c、e、g、i. HE 染色;b、d、f、h、j. Masson 染色。a、b. 手術當日;c、d. 術后第 2 d;e、f. 術后第 4 d;g、h. 術后第 6 d;i、j. 術后第 8 d。手術當日氣管管腔通暢,上皮黏膜組織完整而光滑,未發現有肉芽組織增生或管腔狹窄。機械損傷后第 2 d 即可觀察到肉芽組織,其間可見散在成纖維細胞及炎性細胞,成纖維細胞在第 4 d 左右呈爆發式增殖,伴大量炎癥細胞浸潤,在第 8 d 部分成纖維細胞胞體變小變狹長,細胞核變小,轉化為纖維細胞。Masson 染色見損傷部位的成纖維細胞呈先增多后下降趨勢,損傷部位的膠原纖維隨著時間而逐漸增多
3 討論
國外氣道狹窄的病因構成中主要以肺移植及長期氣管插管或造口術后狹窄為主[1, 4]。我國既往以氣管結核居首位,占所有病因的 60% 以上;長期氣管插管或氣管造口所致氣管狹窄居第二位,約占 15.0%[5-6]。近年來,隨著危重癥醫學的發展、呼吸支持技術在危重患者救治中的廣泛運用,以及肺移植、氣道手術的開展和普及,嚴重氣道并發癥的發生率逐漸提高[7-10]。氣管插管或切開所占良性中央氣道狹窄的病因比重大大提高,或將取代結核成為首要致病因素。Myer 等[11]根據阻塞情況將氣道狹窄分為 4 度。通常患者在狹窄超過 50%,即 2 度以上狹窄后才出現相關癥狀,很多患者直到突發感染、水腫、黏液栓塞等致死性氣道阻塞時才得以診斷。有將近 10% 的良性氣道狹窄患者被漏診或誤診[12-13]。當前,良性氣道狹窄的治療手段主要為手術切除狹窄段及斷端吻合、球囊擴張、支架置入、熱消融、冷凍治療、局部絲裂霉素 C 等藥物治療、局部/全身應用類固醇激素、腔內近距離放療等[1-22],但療效均有限,再狹窄率極高且需要定期氣管鏡隨訪。因此迫切需要建立一種簡易、可靠的良性氣道狹窄動物模型,以研究其發病機制、治療干預以及評估療效預后等。
本實驗結果提示:機械損傷可引起上皮結構的破壞及肉芽組織的過度增生,尼龍刷刮擦可以成功制作獲得性良性氣道狹窄模型。氣管插管引發良性氣道狹窄的病理機制主要為長時間插管,安全氣囊對氣管壁產生機械壓迫,引起黏膜缺血、壞死,甚至引起深達軟骨的炎癥。壞死的黏膜脫落后,損傷部位容易合并病原體感染,進一步加重炎癥。損傷處的微環境中促炎因子大量釋放,炎癥細胞增多,成纖維細胞被廣泛募集并通過有絲分裂的方式大量增殖,導致成纖維細胞主導的異常修復。肉芽組織增生可于插管后數小時內開始發生[23-24],而狹窄則通常則在 5 d 之后才開始出現[25]。肉芽組織為幼稚階段的纖維結締組織,由增生的成纖維細胞以及新生薄壁的毛細血管構成,并伴有大量炎癥細胞的浸潤。炎性細胞中常以巨噬細胞為主,分泌大量轉化生長因子-β、白細胞介素-1 及腫瘤壞死因子-α,進一步刺激成纖維細胞及毛細血管的增生。在損傷修復的整個過程中,成纖維細胞發揮著舉足輕重的作用。損傷后前 3 d,成纖維細胞以有絲分裂的方式大量增殖;4~5 d 后,成纖維細胞開始合成和分泌大量的膠原纖維和基質成分,與新生毛細血管等共同形成肉芽組織填補傷口;在修復后期,表現為收縮表型—肌成纖維細胞,造成創面收縮,并通過分泌膠原酶參與修復后組織的改建引起瘢痕攣縮,最終形成瘢痕狹窄[26-30]。本實驗模擬了臨床上常見的繼發于插管或氣管切開等的黏膜機械損傷,各時間截點的大鼠氣管中成纖維細胞及膠原纖維沉積情況與文獻報道的病理病程相符,作為研究良性氣道狹窄的動物模型十分適宜。
不同的實驗目的有不同的造模方法,基本原理相仿,均以破壞黏膜為主。目前常用的制造動物氣道狹窄模型的方法有:機械損傷,包括用毛刷或者活檢鉗等刮擦、咬檢氣管黏膜,氣管內置入球囊導管、金屬支架等[31-33];化學損傷,黏膜下注射鹽酸、NaOH、酒精等[34-36];熱損傷、高頻電燒、氬氣刀、激光等[37]。這些方法可單獨使用,亦可聯合應用。良性氣道狹窄常用的造模動物有兔子[3, 38]、犬類[39]、山羊、豬等[40-41]。本模型采用 SD 大鼠,其體積較小,造模操作更加方便省時,重復性好且價格低廉。但本模型也有一定的局限性,由于大鼠氣管管腔面積基數小,造模后(無任何治療)肉芽組織在造模后第 8 d 幾乎充滿管腔,導致氣道完全閉塞、動物窒息死亡。因此,該模型僅適用于狹窄早期階段(肉芽組織增生期)的研究,不適用于瘢痕狹窄階段。
綜合以上實驗結果可以得出,尼龍刷刮擦機械損傷氣管黏膜的方式可以成功建立穩定、可靠的良性氣道狹窄急性模型。其病理進程與臨床上插管、造口等引起的良性氣道狹窄相仿,可用于良性氣道狹窄致病機制的研究和新藥療效的探索。