乳腺癌是全球最常見的、女性中致死人數最多的惡性腫瘤。美國國家綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)更新了2023年版的《NCCN乳腺癌風險降低指南》。該指南基于高級別循證醫學證據和最新研究進展,針對沒有浸潤性乳腺癌或導管原位癌病史的個體,提供了具有規范化指導意義的乳腺癌風險評估和風險降低策略,受到全球臨床醫生的廣泛關注。乳腺癌也是我國女性最高發的惡性腫瘤,由于我國人口基數大,年新增乳腺癌病例數位居全球首位,乳腺癌防控已經成為我國重大的公共衛生難題。本文將結合亞洲女性乳腺結構特點以及我國乳腺癌的流行病學特點,對新版指南內容進行逐一解讀,以期為我國的乳腺癌防控提供參考。
引用本文: 郭心怡, 呂青. 2023年《NCCN乳腺癌風險降低指南》解讀. 中國胸心血管外科臨床雜志, 2023, 30(6): 787-804. doi: 10.7507/1007-4848.202303034 復制
乳腺癌是全球最常見的、女性致死人數最多的惡性腫瘤[1]。據估計,2020年全球新發乳腺癌約226萬例,約68萬人死于乳腺癌[1];其中,我國新發乳腺癌達41萬例,約占全球的1/5[1],且自1990年以來,我國乳腺癌發病率的增長速度達到全球的兩倍以上,乳腺癌正嚴重威脅著我國女性的身體和心理健康,給社會公共衛生體系帶來巨大負擔,實現有效的乳腺癌防控已成為我國亟待解決的一大難題,因此,制定有效的乳腺癌風險評估方案、實施可靠的乳腺癌風險降低策略勢在必行。
2022年10月美國國家綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)更新了2023年版的《NCCN乳腺癌風險降低指南》,針對沒有浸潤性乳腺癌或導管原位癌(ductal carcinoma in situ,DCIS)病史的人群,為臨床醫生提供具有規范化指導意義的乳腺癌風險評估方案和風險降低策略。盡管我國與西方人群在種族、生活環境、生活方式等風險因素以及乳腺癌患者的臨床特點和病理特征等諸多方面存在差異,西方國家制定的風險評估模型在我國的應用價值也有限,但是我國在乳腺癌預防和控制方面明顯滯后于西方發達國家,我國作為乳腺癌的主要發病大國之一,該指南仍能為我國的乳腺癌風險降低戰略提供重要參考依據和借鑒價值。
為幫助我國醫生針對乳腺癌高危人群應用個性化策略降低乳腺癌風險,本文將結合亞洲女性的乳腺結構特點以及我國乳腺癌的流行病學特點,從乳腺癌的風險因素、風險評估模型、降低風險的干預措施以及干預相關的不良反應4個方面分別對該指南進行解讀,并對乳腺癌高危人群識別與管理的全流程進行梳理,旨在為我國乳腺癌防控事業的落地實施尋求有價值的啟發和借鑒。
1 乳腺癌的風險因素
乳腺癌的發病風險因素包括家族/遺傳風險因素和個人風險因素兩大類,但真實世界中僅有10%~15%的乳腺癌發病可歸因于遺傳因素,而絕大部分乳腺癌的病因尚不完全明確,可能是多種風險因素共同影響[2]。由于我國種族特征、經濟發展、生活方式等與西方國家有所不同,因而風險因素與乳腺癌發病率之間的關聯可能與西方國家存在細微差異,但大部分的風險因素相似[3-4]。
1.1 家族/遺傳風險因素
根據世界衛生組織(World Health Organization,WHO)2020年的數據,中國女性終身的乳腺癌發病風險約為5.3%[1]。然而某些與乳腺癌風險密切相關的高外顯率基因發生致病/可能致病(pathogenic/likely pathogenic,P/LP)的突變時,會將突變攜帶者的終身乳腺癌風險提高至20%~60%以上,特別是許多與標志性遺傳性疾病相關基因的P/LP突變會大幅提高攜帶者的終身乳腺癌風險(表1),包括遺傳性乳腺癌和卵巢癌相關的乳腺癌易感基因1/2(BRCA1/2)[5-7]、李法美尼綜合征(Li-Fraumeni syndrome,LFS)相關的TP53基因[7-8]、考登綜合征(Cowden syndrome)/張力蛋白同源的第10號染色體缺失的磷酸酶(PTEN)錯構瘤綜合征(PTEN hamartoma tumor syndrome,PHTS)相關的PTEN基因[7, 9]、遺傳性彌漫性胃癌相關的上皮-鈣粘連素1(CDH1)基因[7, 10]以及Peutz-Jeghers綜合征相關的絲氨酸-蘇氨酸激酶11(STK11)基因[7, 11]等。此外,還有許多缺乏標志性遺傳病的基因P/LP突變也會不同程度地提高乳腺癌風險,如乳腺癌易感基因相關蛋白2(PALB2)、共濟失調毛細血管擴張突變(ATM)、BARD1、檢查點激酶2(CHEK2)、神經纖維瘤病1型(NF1)、RAD51C或RAD51D基因等[7]。攜帶上述基因P/LP突變的個體均視其具有已知的乳腺癌遺傳易感性。在我國乳腺癌患者中,BRCA1和BRCA2基因P/LP突變發生率分別約為1.9%和2.1%[12],而TP53、PTEN、STK11、CHEK2、NF1等基因的P/LP突變率約為0.18%~0.44%[13]。
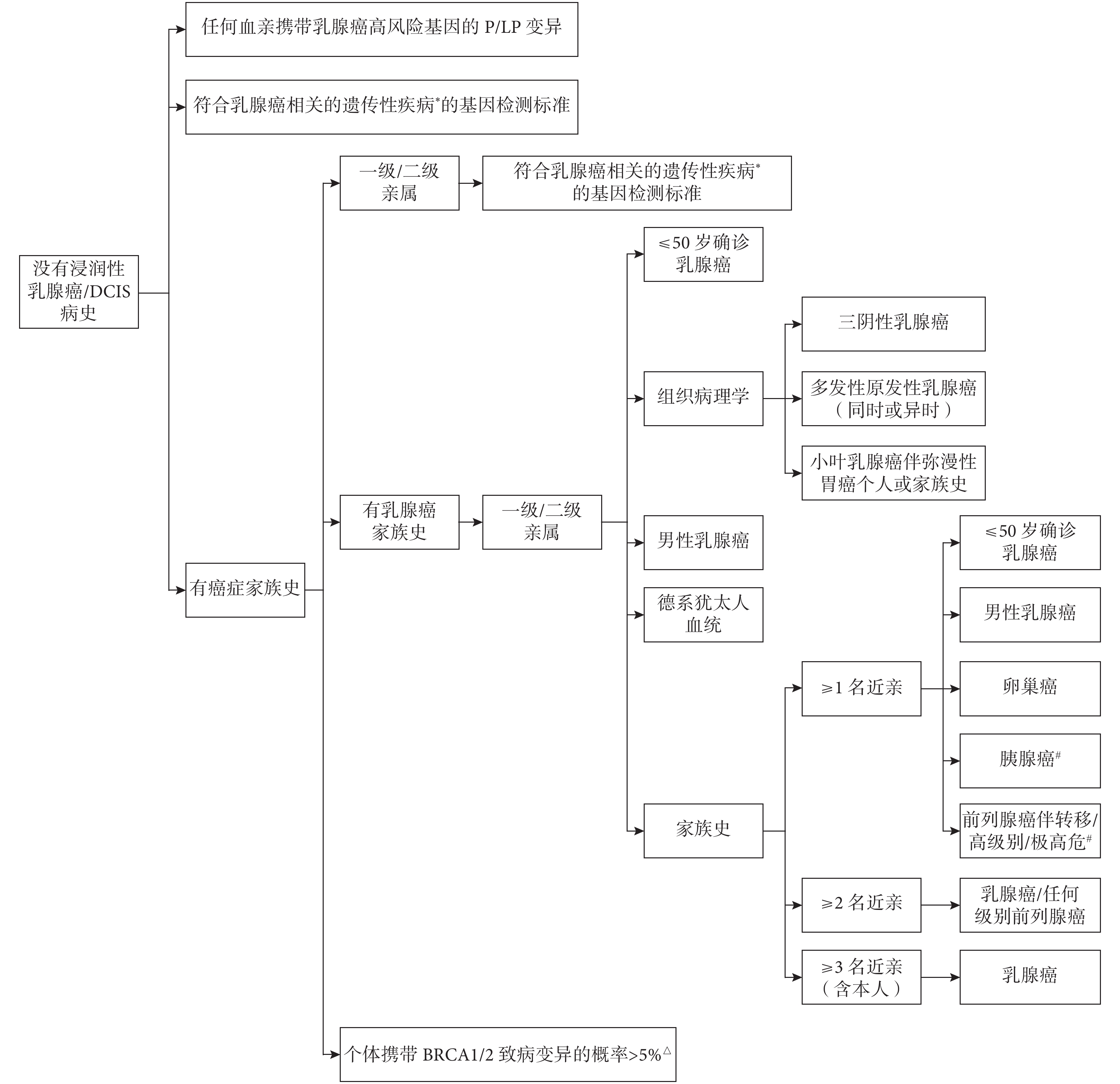
對于上述基因P/LP突變未知的個體,則需要使用乳腺癌的家族/遺傳風險標準[7]進一步評估乳腺癌的遺傳易感性。該標準主要考慮以下因素:(1)家族中是否有上述遺傳基因P/LP突變攜帶者,這些基因突變多表現為常染色體顯性遺傳模式,攜帶者的子女有50%的概率遺傳其突變[7];(2)經模型(如BRCAPro模型、CanRisk工具等)預測個體攜帶BRCA1/2致病突變的概率;(3)個體或家族中是否有LFS、考登綜合征/PHTS等病史[7];(4)個體或家族中是否有卵巢癌(特別是上皮性卵巢癌)[14]、胰腺癌(特別是外分泌胰腺癌)[15-16]、前列腺癌、結直腸癌或彌漫性胃癌等癌癥病史;(5)家族中是否有乳腺癌病史,包括乳腺癌確診年齡、病理組織學類型[17-19]、是否男性乳腺癌[20];(6)家族中是否有德系猶太人血統[21-22]等。由于該標準較為復雜,本文僅將其整理概括為圖1(具體詳見《NCCN遺傳/家族風險評估指南:乳房和卵巢》[7])。滿足≥1條標準者攜帶乳腺癌易感基因P/LP突變的概率增加,因而患家族性/遺傳性乳腺癌的風險可能增加,視為具有家譜提示的乳腺癌遺傳易感性,本指南建議進行正式的遺傳評估和咨詢(包括可能的基因檢測等)進一步明確乳腺癌風險。
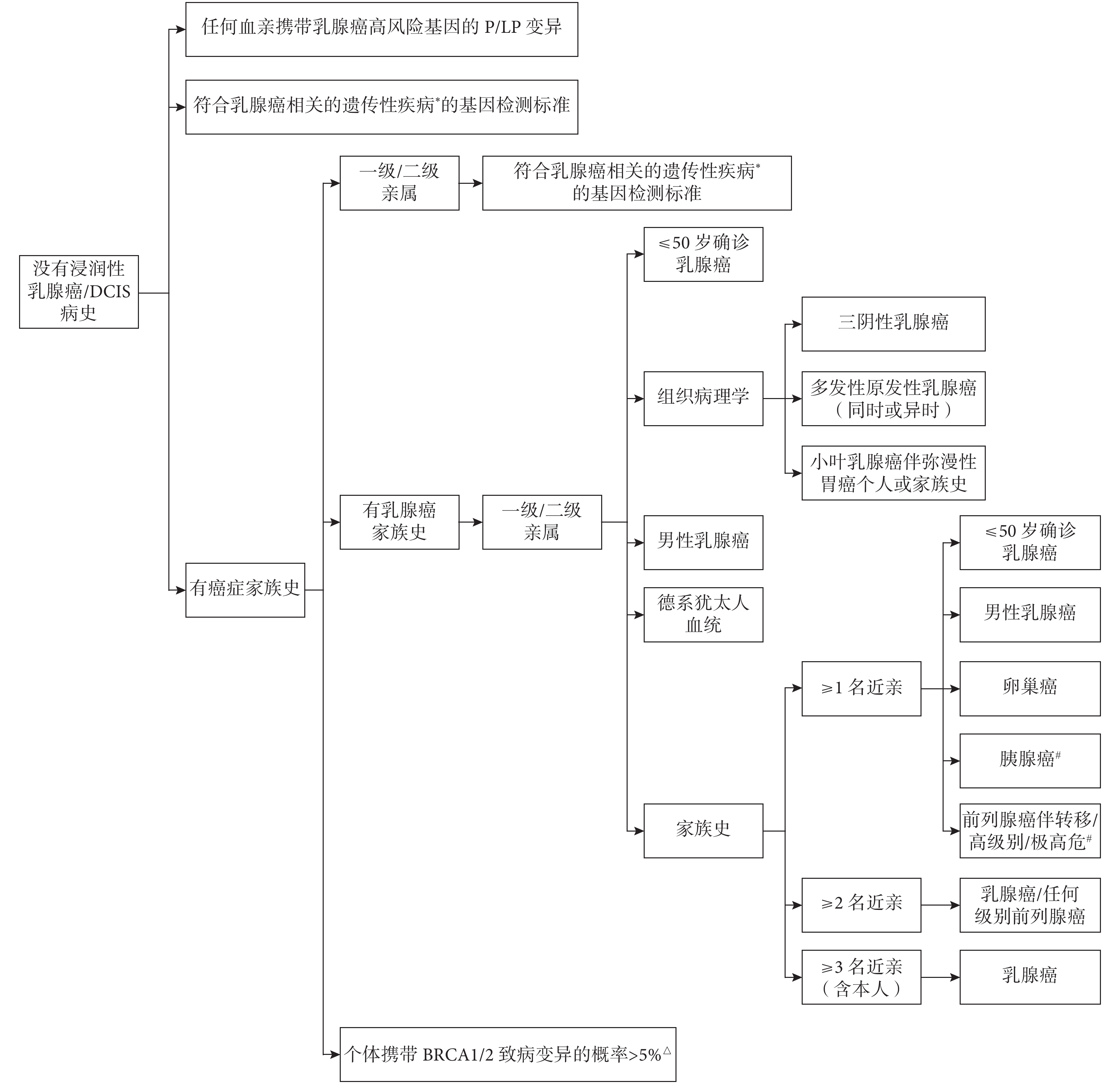 圖1
針對沒有浸潤性乳腺癌/DCIS病史人群的家族/遺傳風險標準[7]
圖1
針對沒有浸潤性乳腺癌/DCIS病史人群的家族/遺傳風險標準[7]
DCIS:導管原位癌;P/LP:致病/可能致病;*與乳腺癌相關的遺傳性疾病包括Li-Fraumeni綜合征、Cowden綜合征/PTEN錯構瘤綜合征(PHTS);#對于胰腺癌或前列腺癌,只考慮一級親屬的家族史;△基于BRCAPro、CanRisk等模型的預測結果
1.2 個人風險因素
目前較為公認的影響乳腺癌風險的因素較多,結合指南將其歸為以下5類(表2)。
1.2.1 人口學因素
人口學因素包括性別、年齡、民族/種族等。研究[21-22]顯示,女性是乳腺癌的主要受累群體;而德系猶太人中較高的BRCA1/2突變率可能增加乳腺癌風險,常見致病突變BRCA1 185delAG和BRCA2 6174delT的突變概率分別約為1.09%和1.52%,而這些突變在美國人群中的發生率至少<0.1%。此外,隨著年齡增加乳腺癌風險也逐步增加,由≤49歲時的1.9%增加到≥70歲時的6.7%,這可能與年齡增加所致的染色體穩定性下降、免疫系統功能衰退等有關[23]。然而,與西方國家相比,我國乳腺癌發病呈現年輕化:美國的乳腺癌發病高峰為55~64歲[24],而我國呈現雙峰分布,主要發病高峰為45~55歲,較西方國家更加年輕[25],確診時≥65歲的乳腺癌患者僅有23.6%(美國有46.5%)[1]。我國乳腺癌相對年輕化的特定發病峰值可能與出生隊列效應有關,考慮源于特定時期出生人群的月經和生殖模式以及其他生活方式和環境因素等的變化[26]。與2008年相比,我國乳腺癌的確診年齡正在逐步向后推移,并且根據預測模型的分析還將繼續后移[27]。
1.2.2 生殖相關內源性雌激素暴露因素
目前認為,月經初潮早(≤12歲)[28-29]、未產[28]、初次活產年齡晚(≥35歲)[28]、絕經年齡晚(≥55歲)[28]會增加乳腺癌風險;而絕經早(<45歲)[28]、母乳喂養[30]會降低乳腺癌風險,終身母乳喂養時間越長乳腺癌風險越低。在中國人群中發現,終身生育數量下降可能通過影響上述因素(如縮短終身哺乳時間)而增加乳腺癌風險[31]:由于我國生育政策推行和經濟水平逐步提高,中國的總生育率(每名女性的平均生育數量)從上世紀50年代的6.0下降到2010年的1.6,這一趨勢在經濟較為發達的東部沿海地區(特別是上海市)尤為明顯[27];而與之相伴的是,中國女性的乳腺癌發病率也迅速上升[1],從1988年的27.6/10萬到2008年的43.9/10萬[32],以東部沿海城市地區最高,2008年達46.35/10萬[33]。此外,針對中國人群的研究還發現流產次數≥3次[34]、月經周期不規律[35]等因素可能也與乳腺癌的發病有關。
1.2.3 生活方式因素
(1)絕經后體重指數(body mass index,BMI)是乳腺癌的獨立危險因素。絕經后超重(BMI 25~30 kg/m2,我國人群BMI 24~28 kg/m2)或肥胖(BMI>30 kg/m2,我國人群BMI>28 kg/m2)會增加絕經后乳腺癌風險[36-37], BMI≥25.9 kg/m2者乳腺癌風險約為BMI<20.5 kg/m2者的2.54倍[36],特別是激素受體陽性型乳腺癌[38],這種關聯可能歸因于脂肪組織來源的循環內源性雌激素水平增加[36]。研究[39]表明,在中國女性中BMI對乳腺癌風險的影響更大,無論是否絕經,超重或肥胖者乳腺癌風險增加4倍。隨著我國傳統飲食模式向西方飲食模式的轉變(即快餐文化的普及)[40],越來越多成年女性(32.1%)甚至是青少年(28.7%)處于超重甚至肥胖狀態[27],這一趨勢可能也是我國乳腺癌發病率逐漸增加的原因之一。
(2)酒精攝入與乳腺癌風險增加有關,每天每攝入10 g酒精,乳腺癌風險增加約10%[41-43],即使輕度酒精攝入也會使乳腺癌風險顯著增加5%[44]。酒精作為輔助致癌物,可能通過提高細胞膜對致癌物的通透性、抑制致癌物的解毒作用等提高乳腺癌風險[42]。
(3)當前或既往雌/孕激素使用也可能增加乳腺癌風險。年輕女性使用口服避孕藥可能增加乳腺癌風險,且持續時間越長乳腺癌風險越高[45]。絕經后女性接受激素替代治療(hormone replacement therapy,HRT)也可能增加乳腺癌風險:隨機對照試驗[46]顯示,有完整子宮者接受雌激素+孕激素治療期間乳腺癌風險約增加62%~91%,治療停止后1年內增加的風險迅速下降至正常;觀察性研究[47-49]顯示子宮切除術后患者在絕經時或更早即開始單用雌激素治療也會使乳腺癌風險增加30%~42%;而隨機對照試驗[50]顯示,絕經后數年開始接受雌激素治療似乎不增加乳腺癌風險,甚至使乳腺癌風險降低23%[51]。對此可能的解釋是,一段時間雌激素剝奪后短期使用雌激素可能會通過誘導隱匿性乳腺癌的腫瘤細胞凋亡來降低乳腺癌風險,而長期持續使用雌激素可能會引發和促進新腫瘤的生長,從而增加乳腺癌風險[52]。然而,激素宮內節育器(intrauterine devices,IUDs)的激素全身吸收非常少,乳腺癌風險增加較少(16%~21%)[53-54]。由于我國人群對用藥(特別是激素類藥物)的排斥心理,目前使用雌/孕激素藥物的現象在我國并不算多見,但隨著當代年輕人思想逐漸開放,加之絕經后雌激素補充有益于提高女性生活質量和維護心血管及骨健康,未來對我國乳腺癌發病的影響仍不容小覷,使得我們面臨的問題更加復雜,如何權衡絕經后HRT的利弊將成為新的課題。
(4)當前或既往吸煙也能使乳腺癌風險分別增加24%和13%,特別是吸煙起始年齡較小者。Meta分析[55]結果顯示,月經初潮前或初潮后但距離初次生育≥11年即開始吸煙使乳腺癌風險分別增加61%和45%,可能的原因是乳腺組織直到初次妊娠完成才發育完全,在此之前的乳腺生長發育期對尼古丁、焦油等基因毒性物質的暴露更敏感[56]。
(5)運動也能在一定程度上降低乳腺癌風險。Meta分析[57]顯示,每周進行≥150 min的劇烈運動能使乳腺癌風險降低9%,這可能與運動通過減少脂肪組織從而降低脂肪組織來源的雌激素有關[58]。而我國人群普遍缺乏運動,平均運動量遠低于西方國家水平,但隨著近年來逐漸意識到運動對于健康的重要性,越來越多的人加入健身行列,我國的運動情況在未來幾十年可能會逐步得到改善。
(6)乳腺癌風險降低藥物的既往用藥史與乳腺癌風險降低有關(詳見3.2)。目前的風險降低藥物主要通過干擾雌激素的合成或作用機制從而降低乳腺癌風險,如他莫昔芬和雷洛昔芬等雌激素受體調節劑(selective estrogen receptor modulators,SERMs)通過與雌激素受體結合而阻礙雌激素發揮作用[59],依西美坦和阿那曲唑等芳香化酶抑制劑(aromatase inhibitors,AIs)通過抑制芳香化酶作用而降低外周組織的雌激素合成[60]。然而,目前乳腺癌高危人群使用風險降低藥物預防乳腺癌的現狀并不樂觀。國外研究[61]顯示只有44%的非典型增生(atypical hyperplasia,AH)/小葉原位癌(lobular carcinoma in situ,LCIS)患者接受風險降低藥物治療;而我國醫生(特別是基層醫生)對乳腺癌高危人群藥物預防的認識程度非常不足,加之國民對藥物不良反應的恐懼心理和服藥的排斥心理,致使用藥的依從性極差,盡管沒有確切數據,但現實觀察可見我國乳腺癌高危人群接受藥物預防的比例只會更小。
(7)本指南沒有提及的精神心理因素也可能是乳腺癌的風險因素[62],特別是對于中國女性[63],如不良情緒、情緒調節能力差、不良生活事件或缺乏社會心理支持等都可能增加乳腺癌風險[62-63]。隨著我國(特別是東部沿海城市)經濟水平的迅猛發展,工作壓力增加帶來不良情緒增加的同時又降低了情緒調節能力,以工作為重心的生活方式繼發社交生活匱乏以及社會心理支持不足,這可能也是近年來我國(特別是東部沿海城市)乳腺癌發病增加的原因之一。
1.2.4 乳腺相關病史因素
(1)乳腺增殖性病變背景。扁平上皮異型性(flat epithelial atypia,FEA)與無異型性的良性增殖病變對乳腺癌風險影響不大;而有異型性的增殖病變,包括AH[含非典型導管增生(atypical ductal hyperplasia,ADH)和非典型小葉增生(atypical lobular hyperplasia,ALH)][64]和LCIS[65],與乳腺癌風險增加有關。其中ADH者和ALH者的乳腺癌風險分別為良性非增殖性乳腺疾病者的2.4倍和5.3倍[64],而LCIS者乳腺癌風險大幅增加,其10年和20年乳腺惡性腫瘤的累積發病率分別為11.3%和19.8%[65]。
(2)既往乳腺活檢病灶數量,包括切除活檢、粗針活檢或細針穿刺(fine-needle aspiration,FNA),同一病灶的多次活檢按單個活檢計,數量越多乳腺癌風險可能越高。
(3)乳房X線檢查的乳腺密度(腺體和纖維組織體積/乳房總體積),包括乳腺密度不均(c型,乳腺密度51%~75%)和(或)致密乳腺(d型,乳腺密度>75%),特別是致密乳腺越來越被認為是乳腺癌的重要危險因素,其乳腺癌風險約為乳腺密度<10%者的4.7倍[66]。雖然亞洲女性乳房普遍更為致密(c型56.09%,d型27.13%)[67],但在我國似乎并未發現乳腺密度與乳腺癌風險的關聯[68-69]。
(4)有<30歲時的胸部/乳房放射治療(radiation therapy, RT)史,如<16歲時接受過胸部RT治療霍奇金淋巴瘤后的幸存者成年后乳腺癌風險明顯增高,其相對風險在治療后10~14年時為71.3,15~19年時達到90.8,隨后緩慢下降[70]。
1.2.5 環境因素
本指南并未涉及的環境因素也是近年的研究熱點之一。除了內源性雌激素暴露,女性一生中還有更為復雜的外源性內分泌干擾物(endocrine-disrupting chemicals,EDCs)和其他環境致癌物的暴露,后者也是導致乳腺癌發病率增加的重要原因之一[71]。多項研究結果表明,EDCs對內環境的干擾已經成為一個重要的公共問題。美國內分泌協會(The Endocrine Society,TES)于2009年發表的第一份關于EDCs對人類疾病發展作用的科學聲明(稱為“EDC-1”)[72]指出,EDCs代表一大類化學物質,廣泛存在于自然環境或食品用品中,如植物殺蟲劑或除草劑(有機氯類等)、化工原料(塑料、橡膠等)、金屬材料等,其中最主要的為環境雌激素(environmental estrogens,EEs),其可通過干擾內源性激素的生物合成、作用機制或代謝途徑,破壞體內正常的激素調節過程,引發生殖調控的紊亂。
研究[73-75]發現,EEs對乳腺癌風險的影響在女性一生中乳腺發育的4個敏感窗口期最為顯著,包括:產前期(胎兒期)、青春期、懷孕期和更年期。目前與乳腺癌相關性較高的三種常見EEs分別是:(1)雙酚A(bisphenol A,BPA)廣泛用于罐頭或飲料包裝、水瓶等塑料制品中;(2)鄰苯二甲酸酯(phthalates,PAEs),作為增塑劑多存在于塑料制品、化妝品、裝修涂料、香味產品(香水等)中;(3)多氯聯苯(polychlorinated biphenyls,PCBs),常作為添加劑存在于橡膠、潤滑油、防火劑等[76]。當代年輕人工作繁忙,長期頻繁食用塑料包裝的各類食品,富含油脂的高溫飯菜更易溶解塑料包裝(特別是不合格餐盒)中的多種EEs,EEs多為脂溶性,進入體內代謝非常緩慢,攝入后在體內長期累積,可能導致乳腺癌風險增加等健康隱患,這或將成為我國乳腺癌防控中新的巨大挑戰。
2 乳腺癌風險的評估
盡管對乳腺癌發病風險因素的研究眾多,但是乳腺癌發病仍然是一個綜合、復雜和未知的過程,如何評估個體的乳腺癌發病風險一直是研究的熱點和難點,也是目前乳腺癌防控的重要切入點。目前,乳腺癌風險預測模型是最公認的個體乳腺癌風險評估方法,但是,迄今為止,沒有一個模型能夠完整納入所有的乳腺癌風險因素,對乳腺癌風險進行全面且充分的評估;也還沒有一個模型能夠良好預測所有人種的乳腺癌患病風險。本指南推薦的乳腺癌風險評估模型包括:改良Gail模型、國際乳腺癌干預研究(International Breast Cancer Intervention Study,IBIS)/Tyrer-Cuzick模型、乳腺癌監測聯盟(The Breast Cancer Surveillance Consortium,BCSC)風險計算器2.0版、BRCAPro模型和CanRisk工具,均可在線使用。其中,后兩者能評估個體攜帶BRCA1/2基因P/LP突變的風險。
2.1 改良Gail模型
改良Gail模型是目前最為經典的乳腺癌風險評估模型。該模型納入7項風險因素,包括:年齡、種族、月經初潮年齡、初次活產年齡或未產、患乳腺癌的女性一級親屬人數、既往乳腺活檢的良性病灶數量、活檢組織學檢查是否診斷AH。該模型能夠對個體5年和終身乳腺癌風險進行評估[77],5年風險≥1.7%者通常視為乳腺癌高危人群,本指南認為可以考慮使用藥物降低乳腺癌風險,而5年風險≥3%者本指南則推薦使用藥物降低乳腺癌風險。但該模型對家族史的評估不夠全面,且僅適用于≥35 歲人群,不適用于有FEA的個體。該模型用于以下人群時可能低估其風險:(1)已知的乳腺癌遺傳易感性基因突變攜帶者,如BRCA1/2、TP53、PTEN等;(2)有明顯的乳腺癌家族史者;(3)有卵巢癌家族史者;(4)有AH或LCIS者;(5)既往接受了胸部RT者。
2.2 IBIS/Tyrer-Cuzick模型
該模型是主要依賴家族史的乳腺癌風險評估模型,與改良Gail模型相比更復雜但更全面。該模型全面納入家族史和整體家族結構,同時結合BRCA1/2基因檢測結果、個體卵巢癌病史以及個人風險因素,更加充分地評估10年和終身乳腺癌風險[78]。10年風險≥5%者通常視為乳腺癌高危人群,本指南推薦使用藥物降低乳腺癌風險,而對于剩余終身風險≥20%者本指南視其為具有模型提示的乳腺癌遺傳易感性。其中,對家族史的評估包括一、二、三級親屬是否確診乳腺癌或卵巢癌、是否存在BRCA1/2基因突變;納入的個人風險因素包括年齡、種族、生殖相關因素(月經初潮年齡、初次活產年齡、絕經年齡)、BMI、HRT的持續時間、乳腺活檢史和結果(含AH或LCIS)、乳腺密度等[78]。該模型適用人群年齡段更寬,可用于<35歲的女性,但仍未考慮胸部RT的影響,且該模型用于以下人群時可能高估其風險:(1)西班牙裔個體;(2)有AH或LCIS者;(3)致密乳腺者。
2.3 BCSC風險計算器 2.0 版
該模型結構簡單、評估過程迅速,僅納入了5個因素,包括年齡、種族、女性一級親屬的乳腺癌家族史、乳腺活檢史和結果(含AH或LCIS)、乳房X線檢查的乳腺密度BI-RADS分類,能夠對5年和10年乳腺癌風險進行評估,同時展示同年齡同種族女性5年和10年的乳腺癌平均風險供使用者參考[79]。但該模型在家族史、遺傳易感性基因突變方面與改良Gail模型有著相似的局限性,并且僅適用于35~74歲人群,不適用于有乳腺癌、DCIS、隆胸術或乳腺切除術既往史的個體。
2.4 BRCAPro模型
該模型也是主要依賴家族史的乳腺癌風險評估模型。該模型基于一、二級親屬的乳腺癌和卵巢癌家族史,將無病史的親屬與SEER數據進行比較,能通過計算BRCA1/2 基因的單個和組合概率,繼而預測個體乳腺癌風險。但該模型可能會低估卵巢癌或前列腺癌家族的攜帶頻率,且未考慮其他乳腺癌遺傳易感性基因,也未納入三級親屬。
2.5 CanRisk工具
該模型是基于家族史和中高風險乳腺癌/卵巢癌易感基因(包括BRCA1/2、PALB2、CHEK2、ATM、BARD1、RAD51C 和 RAD51D)變異的綜合模型,復雜而龐大,結合直系/遠親的乳腺癌/非乳腺癌家族史、常見的中高風險易感基因變異[總結為多基因風險評分(polygenic risk scores,PRS)]、生活方式和激素暴露、乳房X線檢查的乳腺密度等信息,預測上述中高風險易感基因P/LP突變(包含單核苷酸多態性(single nucleotide polymorphisms,SNPs)的攜帶概率以及未來的乳腺癌和卵巢癌風險。然而,該模型仍有未考慮到的個人風險因素,如母乳喂養、既往乳腺活檢和異型性增殖病變、胸部RT等,并且本指南不鼓勵在風險評估中常規使用PRS。
但這些模型均是基于西方人群建立的,在我國人群中的應用價值可能有限。目前最為常用的兩大模型改良Gail模型和IBIS/Tyrer-Cuzick模型在中國女性中預測5年乳腺癌風險的曲線下面積僅分別為0.665和0.786[80]。因此,在西方國家廣泛推崇的模型對于我國女性乳腺癌風險具有一定的預測能力,但準確性不足[81],這可能是由于我國與西方國家的乳腺癌風險因素存在差異,如我國女性乳房體積更小更致密、乳腺癌發病年齡更早等[82-83],導致模型納入的危險因素及其所占權重并不完全適用于我國女性。研究證實,結合了遺傳風險因素的IBIS/Tyrer-Cuzick模型在中國女性中的預測效果較Gail模型更好[84];而將Gail模型結合我國乳腺癌風險因素特點,包括我國個性化的流行病學特點[63]和影像學因素(超聲[85]、X線[86])等,其預測效果也有所提高。另外,上述乳腺癌風險預測模型均未納入環境因素,而近年來越來越多的研究開始發現并重視不良環境因素的長期暴露會導致乳腺癌發病風險升高和發病提前,作為發展中國家,我國的EEs暴露問題可能更加嚴峻。因此,我們需要在經典模型的基礎上結合中國實際情況,逐步構建適合中國女性的乳腺癌風險評估模型。
同時,西方國家醫療負擔適度,平均每千人擁有的醫生數量更多,就診評估模式更為精細全面,醫生更傾向使用風險評估模型對個體的風險進行全面的評估。然而,我國醫療負擔較重,平均每千人擁有的醫生數量不足,診療任務超負荷,門診就診節奏快,缺乏充足的時間關注疾病預防,而專業的疾病防控人員也嚴重不足,因此太多太復雜的風險評估模型無法在真實世界中得到應用。雖然西方模型在我國的應用價值可能有限,但具有中國特色的模型構建還需要時間,且模型也不是評估乳腺癌風險的唯一標準,因此就目前的情況,我們仍然建議可考慮在我國選擇兩個經典模型配合其他風險評估策略進行人群乳腺癌風險的初篩,其中首選簡單快捷的改良Gail模型和主要依賴家族史的IBIS/Tyrer-Cuzick模型,而網頁版使用略顯不便,最好能開發手機軟件或微信小程序等快速評估手段;同時我們建議加強我國人群乳腺癌風險預測模型的研究,包括考慮納入外源性EEs暴露等風險因素,以便較準確地錨定真正的乳腺癌高風險人群,更為精準地實施預防管理,降低社會成本,有效降低我國乳腺癌發病率。
3 降低乳腺癌風險的干預措施
基于上述乳腺癌風險因素,采取相應的干預措施,尤其是對乳腺癌高危人群進行合理而恰當的干預,有望降低乳腺癌發病率。目前較為公認的降低乳腺癌風險的主要干預措施有:生活方式、藥物預防、手術預防。
3.1 改變生活方式
盡管改變生活方式與乳腺癌風險之間的關聯尚不完全明確,但本指南仍然推薦可能降低乳腺癌風險的健康生活方式:(1)使用雌/孕激素聯合藥物≥3~5 年可能與乳腺癌風險增加有關,指南建議乳腺癌高危人群應慎用雌/孕激素,特別是絕經后應慎用HRT,并且反對在服用風險降低藥物預防期間使用HRT。(2)任何酒精攝入都會增加乳腺癌風險,指南建議最好避免酒精攝入,而飲酒人群應將飲酒量限制在每天≤1杯,每周≤3杯(1杯的定義約為28 g白酒、170 g葡萄酒或226 g啤酒)。(3)超重或肥胖者有更高的絕經后乳腺癌風險,指南建議將BMI控制在20~25 kg/m2(對于我國人群可能需控制在20~24 kg/m2)有助于降低乳腺癌風險。(4)增加軀體運動水平與乳腺癌風險降低有關[87],指南建議,每天加強運動,避免久坐不動,每周參加≥150 min的中等強度體育活動。(5)一些證據表明,富含水果和蔬菜的飲食結構可以降低乳腺癌風險[88],維生素D(包括食物和皮膚來源)也可能對乳腺癌風險有保護作用[89]。(6)鼓勵適當改變可能具有保護作用的其他因素,如:盡可能在年輕時初次分娩、提倡母乳喂養等。(7)本指南沒有提及的精神心理因素也可能與乳腺癌風險有關,我們建議可適當進行冥想、瑜伽等放松身心的活動調節情緒,遇事尋求家人朋友的幫助,合理釋放不良情緒、應對不良生活事件,必要時尋求社會心理支持。(8)EEs可能增加乳腺癌風險,我們建議盡可能減少加工食品(尤其是肉制品)的攝入,進食天然新鮮烹飪的食物;盡量避免使用塑料制品盛裝高溫食物和飲料;減少攝入脂肪含量高的動物食品及腌臘燒烤等。
3.2 降低乳腺癌風險的藥物
現有的降低乳腺癌風險的藥物包括兩類:(1)SERMs,包括他莫昔芬和雷洛昔芬;(2)AIs,包括依西美坦和阿那曲唑(表3)。屬于乳腺癌一級預防的范疇,也稱藥物預防。但風險降低藥物在<35歲人群中的效用尚不清楚,目前僅適用于≥35歲人群。除他莫昔芬可用于絕經前人群外,其他藥物僅適用于絕經后人群。
3.2.1 他莫昔芬
他莫昔芬是一種SERM,在乳腺癌輔助治療和轉移性乳腺癌解救治療中具有重要價值,用于乳腺癌的輔助治療能降低對側原發性乳腺癌風險[90]。研究顯示,他莫昔芬20 mg/d持續5年用于乳腺癌高危人群,可將5年內乳腺癌風險降低49%,有AH病史者可降低86%,有LCIS病史者降低56%[91],且停藥7年后仍能使乳腺癌風險降低43%[92]。因此,美國食品藥品監督管理局(Food and Drug Administration,FDA)批準他莫昔芬用于乳腺癌高危人群的藥物預防,本指南推薦的他莫昔芬標準用法是20 mg 1次/d(q.d.)持續5年。如標準劑量下出現嚴重副反應、不愿或無法服用標準劑量時,5 mg q.d. 持續3年的低劑量療程可作為備選[93]。雖然目前沒有使用他莫昔芬>5年的數據,但他莫昔芬停藥后長期獲益較好,本指南建議他莫昔芬用于降低乳腺癌風險時5年療程比較合適,不推薦使用>5年。使用他莫昔芬的風險包括:(1)增加子宮內膜惡性腫瘤(包括子宮內膜癌和子宮內膜間質肉瘤)的風險(詳見4.1)[91, 94];(2)增加血栓栓塞風險(詳見4.3)[91, 95-96],故禁用于有血栓病史者或血栓風險高者,包括有深靜脈血栓、肺栓塞、血栓性卒中、短暫性腦缺血發作、已知的遺傳性高凝狀態等病史者;(3)增加白內障的患病風險和手術風險(詳見4.4)[91];(4)可能具有致畸作用(詳見4.6)[97],妊娠或可能妊娠(在沒有有效的非激素避孕方法時)者禁用。
3.2.2 雷洛昔芬
雷洛昔芬是第二代SERM,與他莫昔芬具有相似的抗雌激素作用,但子宮內膜刺激明顯減少。雷洛昔芬降低乳腺癌風險的療效已在多項臨床研究中評估,雷洛昔芬60 mg/d持續5年用于乳腺癌高危人群能使5年內浸潤性乳腺癌風險降低44%[98],并且雷洛昔芬60 mg/d與他莫昔芬20 mg/d在5年治療期間降低乳腺癌風險的療效沒有顯著差異[99],加之雷洛昔芬對骨礦物質密度(bone mineral density,BMD)影響較小,故FDA批準其用于絕經后浸潤性乳腺癌高危人群(特別是患有骨質疏松癥者)的藥物預防,本指南中雷洛昔芬的推薦劑量為60 mg q.d.。然而,雷洛昔芬停藥后長期獲益會減少,研究[100]發現停藥3年后使用雷洛昔芬者的乳腺癌風險較使用他莫昔芬者高24%,本指南認為雷洛昔芬持續使用>5年可能是維持藥物風險降低活性的一種方法。使用雷洛昔芬的風險在于:(1)增加血栓栓塞風險(詳見4.3)[99, 101],故也禁用于有血栓病史者或血栓風險高者;(2)可能具有致畸作用(詳見4.6),妊娠或可能妊娠者禁用。
3.2.3 AIs
臨床試驗[102]證明AIs用于絕經后浸潤性乳腺癌患者的輔助治療能降低對側原發性乳腺癌風險,其效果可能優于他莫昔芬,尤其是對于首發乳腺癌為激素受體陽性的患者。而針對乳腺癌高危人群的隨機對照研究發現,使用依西美坦25 mg/d持續3年[103]或阿那曲唑1 mg/d持續5年[104]分別能使浸潤性乳腺癌風險降低65%[103]或53%[104]。基于上述結果,本指南將依西美坦25 mg q.d.和阿那曲唑1 mg q.d.作為絕經后個體降低乳腺癌風險的藥物選擇,但治療的最佳持續時間尚不清楚,且目前尚未獲得FDA批準。使用AIs的主要風險在于降低BMD(詳見4.2)[105-106],增加骨量減少/骨質疏松風險,從而增加骨折風險。
3.3 乳腺癌風險降低手術
目前,風險降低性乳腺切除術(risk-reducing mastectomy,RRM)也稱預防性乳腺切除術,是降低乳腺癌風險的主要手術方式,效果較為確切,能將BRCA1/2突變攜帶者[107]或有乳腺癌家族史者[108]的乳腺癌風險降低約90%。可選的手術方式包括保留/不保留乳頭的RRM,但無論哪種方式,乳腺切除術的完整性對于最佳風險降低效果至關重要。通常只有以下3種人群建議考慮RRM:(1)乳腺癌高風險基因P/LP突變(不包括意義不明確的突變)攜帶者,主要包括乳腺癌絕對風險>30%的7個基因BRCA1、BRCA2、TP53、PTEN、CDH1、PALB2或STK11[7];(2)有明顯的家族史者;(3)有<30歲時的胸部RT史者。而對于乳腺癌風險增加≥2倍的其他基因P/LP突變(基于大型流行病學研究)攜帶者,在缺乏明顯的乳腺癌家族史情況下,RRM的價值尚不清楚。接受RRM的女性可以選擇是否接受乳房重建手術,包括即刻或延遲乳房重建等。
風險降低性輸卵管卵巢切除術(risk reducing salpingo-oophorectomy,RRSO)主要用于降低個體卵巢癌風險,現有數據也較為支持RRSO用于絕經前女性能降低乳腺癌風險[7, 109-111]。研究[109]顯示,RRSO能使絕經前的BRCA1/2突變攜帶者術后乳腺癌風險降低54%,但對于>50歲女性RRSO降低乳腺癌風險的保護作用可能不再顯著。然而,也有少數研究[112]質疑RRSO降低乳腺癌風險的保護效應。因此,在目前的乳腺癌風險降低治療中,RRSO通常考慮用于乳腺癌和卵巢癌風險均高的基因P/LP突變(如BRCA1/2或PALB2等)攜帶者[7]。
3.4 乳腺癌藥物預防相關的不良反應及其監測與管理
針對乳腺癌高危人群使用藥物預防乳腺癌可能導致發生一系列不良反應的風險增加,然而,對沒有禁忌證的乳腺癌高危人群來說,降低乳腺癌風險的獲益通常超過增加不良反應風險的危害。因此,我們不能因噎廢食,不能因為對不良反應的過度恐慌而放棄乳腺癌的藥物預防,而是應當針對不同人群個性化挑選恰當的藥物,注重用藥期間對不良反應的監測與管理,為乳腺癌高危人群的藥物預防之路保駕護航。
3.4.1 泌尿生殖系統異常
他莫昔芬可能增加子宮內膜惡性腫瘤的風險[91, 94],特別是對于≥50歲人群侵襲性子宮內膜癌的風險增加3倍[91],其機制可能與他莫昔芬對子宮的雌激素激動劑活性有關[113]。但子宮內膜惡性腫瘤的絕對風險很低,對乳腺癌高危人群而言,乳腺癌風險降低的獲益通常超過子宮惡性腫瘤風險增加的危害。對于子宮完整人群,建議在使用他莫昔芬前進行基線婦科評估,并在治療過程中定期進行婦科評估。由于目前沒有足夠的證據推薦對無癥狀個體常規進行子宮超聲檢查或子宮內膜活檢[114],因而本指南認為主要采用婦科體格檢查進行婦科評估是合理的,但《中國抗癌協會乳腺癌診治指南與規范(2021年版)》[115]仍然建議使用婦科體格檢查結合子宮超聲檢查來共同評估。子宮內膜惡性腫瘤的早期典型表現為陰道點滴流血,對于出現異常陰道流血的絕經后個體,應暫停他莫昔芬并及時進一步評估。如發現早期子宮內膜惡變(包括異型增生、癌或肉瘤等),應盡快處理,可考慮在子宮切除術后重新使用他莫昔芬,本指南認為在完成早期子宮內膜癌治療后,恢復風險降低藥物治療是安全合理的;如未發現子宮內膜惡變,則繼續使用他莫昔芬,若癥狀持續存在或復發則需再次評估。
此外,由于雌激素水平下降或雌激素受體功能受抑制,使用風險降低藥物者可能會出現一系列泌尿生殖道癥狀,如陰道干燥、性交困難,以及尿痛、尿急等,可考慮局部使用非激素保濕劑或潤滑劑,或低劑量外用陰道雌激素(盡量避免使用生物同質激素或脫氫表雄酮),并且建議婦科就診。
3.4.2 運動系統異常
骨是一種雌激素反應性組織,乳腺癌藥物預防會給骨的生成與吸收過程帶來影響。研究發現,依西美坦[105]和阿那曲唑[106]都可能加速BMD降低,BMD降低可能進一步增加骨量減少/骨質疏松風險,是AIs治療者需要關注的重要問題。本指南建議絕經后患者在AIs 治療開始前使用雙能X射線吸收測定法(dual-energy X-ray absorptiometry,DEXA)掃描檢測基線BMD,并在治療過程中定期監測。對于接受AIs治療者,為改善BMD并降低骨折風險,結合《中國抗癌協會乳腺癌診治指南與規范(2021年版)》[115],我們建議:(1)進行適當運動,包括阻力運動和負重運動[116];(2)補充鈣和維生素D,國際骨質疏松癥基金會推薦絕經后女性每日攝入1 300 mg鈣和600 U維生素D,接受AIs治療者每日至少攝入800 U(≤2 000 U)維生素D[116];(3)每12個月監測BMD,必要時考慮使用雙膦酸鹽[口服(p.o.)/靜脈注射(i.v.)]或地舒單抗等藥物抑制骨吸收。基于目前的證據,唑來膦酸4 mg,i.v.,每6個月1次(q6mo)是防治AIs相關骨質流失的首選藥物,其他藥物如利塞膦酸鈉35 mg,p.o. ,每周1次或地舒單抗60 mg,皮下注射,q6mo等可酌情選用進行個體化治療[116]。
此外,使用依西美坦和阿那曲唑者可能會出現關節痛等關節癥狀,建議以對癥治療為主,可配合使用針灸、加強運動等,如癥狀持續存在并影響生活,可考慮更換另一種AIs或重新權衡使用風險降低藥物的獲益與風險。
3.4.3 血栓栓塞性疾病
他莫昔芬和雷洛昔芬可能會增加血栓栓塞風險,如靜脈血栓栓塞癥(venous thromboembolism,VTE)[包括深靜脈血栓形成(deep venous thromboses,DVT)和肺栓塞][91, 101]和卒中[95-96, 99]等。盡管如此,用藥后上述血栓栓塞事件的發生率分別都在每年0.1%左右[91],其絕對風險尚在可接受范圍內。由于針對血栓栓塞性疾病的間歇性篩查價值不大,對于服用他莫昔芬或雷洛昔芬的個體應注重宣教,包括交代血栓栓塞性疾病的相關癥狀,并告知長時間制動會進一步增加VTE風險等。本指南建議,對于接受他莫昔芬或雷洛昔芬治療的個體,如處于長時間制動狀態,應立即停藥,優先治療基礎疾病,待解除制動狀態后可繼續用藥,而確診血栓栓塞性疾病者應建議永久停用。
3.4.4 眼部病變
他莫昔芬可能會使白內障的患病風險和手術風險分別增加14%和57%[91]。此外,有案例研究[117]報道他莫昔芬可能與其他眼部病變的發生有關,包括結晶性視網膜沉積物、黃斑水腫、角膜改變或視網膜血管閉塞性疾病等。盡管如此,目前并沒有充分的證據表明他莫昔芬較輕的眼部毒性會限制該藥在乳腺癌預防和治療中的應用[91],但接受他莫昔芬治療時出現視覺癥狀的患者應尋求眼科評估。
3.4.5 潮熱
潮熱是一種常見的圍絕經期主訴,為血管舒縮功能不穩定所致。服用降低乳腺癌風險藥物可能增加潮熱的嚴重程度和/或頻率,其中服用他莫昔芬者(潮熱發生率可達81%)更明顯[91],但是有研究[118]指出使用他莫昔芬者出現潮熱或許可以預測藥物有效及獲益。出現潮熱的個體以對癥治療為主,而且,并非所有潮熱癥狀都需要醫療干預,隨著他莫昔芬用藥時間延長,潮熱癥狀可能自發減少[119]。只有當潮熱持續存在并影響生活質量時,才建議采取干預措施減少甚至消除潮熱,必要時重新權衡評估使用風險降低藥物的獲益與風險。
雌/孕激素雖然具有與SERMs相互作用的潛力,但有研究[120]顯示激素治療可能并不能改善他莫昔芬誘導的潮熱發生率,指南不建議在應用風險降低藥物期間使用雌/孕激素治療潮熱。研究[121]發現一些神經精神類藥物可能具有緩解潮熱的作用,包括加巴噴丁、文拉法辛和帕羅西汀,但仍需要在出現潮熱癥狀(尤其是同時服用他莫昔芬)的人群中評估這些藥物的長期有效性和安全性。有證據表明,某些選擇性5-羥色胺再攝取抑制劑(selective serotonin reuptake inhibitors, SSRIs),如帕羅西汀和氟西汀,可能干擾他莫昔芬向其活性代謝物(吲哚昔芬和4-OH他莫昔芬)的酶促轉化,降低后者的血漿水平,從而影響療效[121]。指南[121]建議使用他莫昔芬的個體需慎用這些藥物,盡可能選擇對吲哚昔芬血漿水平影響最小的藥物,如西酞普蘭和文拉法辛等。可能改善潮熱的其他藥物包括可樂定(口服制劑和透皮貼劑)和維生素E等,其他輔助措施包括放松訓練、針灸、運動、避免咖啡因和酒精等,但還缺乏充足的數據支持。
3.4.6 致畸作用
他莫昔芬[97]和雷洛昔芬都可能具有致畸作用,雖然由于證據有限尚且無法確定因果關系,但本指南仍然建議妊娠或可能妊娠(在無有效的非激素避孕方法時)者禁用他莫昔芬和雷洛昔芬,同時我們建議在停藥后3個月的藥物清除期內繼續進行非激素避孕[122]。
4 乳腺癌的風險管理
乳腺癌的風險管理工作需要針對不同人群制定個性化策略,涉及多層面多角度,內容繁復,亟需一套全面、詳細、清晰的風險管理策略指導我們高效、快捷、準確地制定個性化的乳腺癌風險管理方案。本文結合指南和相關文獻,對乳腺癌高危人群識別與管理流程進行梳理,并根據國情,提出對我國乳腺癌風險管理的一些建議,以期進一步推動我國的乳腺癌風險管理工作。
4.1 乳腺癌的風險評估
首先確認個體沒有浸潤性乳腺癌或DCIS病史,而后開始風險評估過程(圖2),旨在篩選出乳腺癌遺傳風險和(或)個人風險增加的個體。(1)首先評估個體是否攜帶已知的乳腺癌高風險基因的P/LP突變(表1):攜帶者視為具有已知的乳腺癌遺傳易感性;而未攜帶者(包括攜帶意義不確定變異者)或攜帶情況未知者,進一步評估遺傳風險。(2)進一步的遺傳風險評估,需全面評估家族史,判斷個體是否滿足乳腺癌的家族/遺傳風險標準(圖1,詳見指南[7])。滿足≥1條者建議轉診進行正式的遺傳評估和咨詢,包括可能的基因檢測等:基因檢測陽性者(即乳腺癌高風險基因P/LP突變攜帶者)視為具有已知的乳腺癌遺傳易感性;陰性者(即未攜帶者)或未檢測者視為具有家譜提示的乳腺癌遺傳易感性。(3)不滿足標準者、基因檢測陰性或未檢測者進一步評估個人風險因素,并使用風險評估模型綜合評估乳腺癌風險。(4)其中,主要依賴家族史的模型(IBIS/Tyrer-Cuzick等)可進行附加的家族風險評估,乳腺癌剩余終身風險≥20%者視為具有模型提示的乳腺癌遺傳易感性。
乳腺癌家族/遺傳風險增加人群即包括具有已知的、家譜提示的或模型提示的遺傳易感性的個體。而乳腺癌個人風險增加人群包括,(1)有AH/LCIS病史者;(2)有<30歲時胸部RT既往史者;(3)風險評估模型提示乳腺癌風險升高者,如改良Gail模型5年風險≥1.7%或IBIS/Tyrer-Cuzick模型10年風險≥5%的個體等。二者統稱為乳腺癌高危人群。
4.2 乳腺癌高危人群的管理
沒有乳腺癌病史的乳腺癌高危人群,只要有≥1個完整乳腺,都應該接受降低乳腺癌風險管理(圖3),推薦進行降低風險的咨詢,包括咨詢健康生活方式和降低風險選擇。預期壽命<10年者,指南不推薦風險降低治療或乳腺篩查,其獲益可能微乎其微,但推薦通過改變生活方式來降低乳腺癌風險。而預期壽命≥10年者,指南建議:(1)改變不良生活方式;(2)結合個人意愿與醫生共同進行風險降低決策討論;(3)無論是否接受風險降低治療,均應定期進行乳腺篩查。
 圖3
乳腺癌的風險降低管理流程圖
圖3
乳腺癌的風險降低管理流程圖
DCIS:導管原位癌;* 按照《NCCN乳腺癌篩查和診斷指南》[123]進行處理
具有乳腺癌高風險基因P/LP變異或相關遺傳性疾病者[7]以及其他高危人群[123]的乳腺篩查詳細策略應參照相應指南。通常來說,對于大部分高危人群,每6~12個月進行1次臨床乳房體格檢查,每年進行1次雙側乳房X線檢查,并提高乳腺監測意識;對于部分極高危人群(如剩余終身風險≥20%或有<30歲時的胸部RT史等),在此基礎上每年增加1次乳腺磁共振成像(magnetic resonance imaging,MRI)。由于亞洲女性的乳腺普遍較為致密,單獨依靠乳房X線檢查可能會遺漏可疑病變,對于我國人群,基于人群乳腺的結構特點和國情,結合我國指南[115],我們推薦在上述基礎上每6~12個月增加1次乳腺超聲檢查,尤其是對于40歲以下人群,可能乳腺超聲檢查優于X線檢查。
進行風險降低決策時,需注意以下幾點。(1)有AH/LCIS病史者,強烈推薦使用風險降低藥物,能大幅降低乳腺癌風險(AH者降低約86%,LCIS者降低約56%),特別是LCIS者,雖然以前建議考慮RRM,但目前首選風險降低藥物。(2)BRCA1/2突變攜帶者、有<30歲胸部RT史者乳腺癌風險非常高,建議考慮RRM。(3)對于風險評估模型提示乳腺癌風險升高者,改良Gail模型5年風險≥1.7%時可以考慮使用降低風險藥物,但至少Gail模型5年風險≥3%或IBIS/Tyrer-Cuzick模型10年風險≥5%時才推薦使用。
對于愿意接受風險降低治療的個體,首先進行乳腺的基線評估,如不能提供既往的乳腺評估資料,則根據《NCCN乳腺癌篩查和診斷指南》[123]進行乳腺篩查。基線評估如發現異常,則按照指南[123]進行處理;如未發現異常,即可進一步選擇合適的風險降低處理。對于符合風險降低手術標準的個體,應進一步討論手術選擇,愿意接受手術者進行相應手術;對于不符合手術標準或不愿接受手術的個體,<35歲者暫不推薦使用風險降低藥物,≥35歲者應根據絕經狀態和多系統基線評估推薦合適的風險降低藥物。
4.3 風險降低藥物治療的管理
4.3.1 藥物治療前的評估
首先評估患者的絕經狀態,絕經這一概念用于乳腺癌管理主要指卵巢雌激素合成的長期和永久下降。本指南推薦的絕經標準包括:(1)雙側卵巢切除術后;(2)年齡≥60歲;(3)年齡<60歲者未使用化療、他莫昔芬、托瑞米芬的情況下停經≥12 個月;(4)處于卵巢功能抑制狀態且卵泡刺激素(follicle-stimulating hormone,FSH)和雌二醇在絕經后范圍內;(5)年齡<60歲者服用他莫昔芬或托瑞米芬的情況下FSH和血漿雌二醇水平在絕經后范圍內。
而后進行用藥前的多系統基線評估:(1)有完整子宮者需行基線婦科評估,確保在開始治療前沒有需要評估的異常陰道流血;(2)絕經后個體需評估基線BMD,指導藥物選擇;(3)是否有血栓病史或血栓高風險;(4)是否有白內障病史或白內障高風險。
4.3.2 風險降低藥物的選擇及管理
對于絕經前高危人群,他莫昔芬是唯一可用的風險降低藥物,在這類人群中他莫昔芬沒有明顯增加子宮內膜癌的風險[91-92],此時他莫昔芬的風險/獲益比也相對有利。
對于絕經后高危人群,根據基線評估結果可選擇他莫昔芬、雷洛昔芬、依西美坦或阿那曲唑。用藥早期雷洛昔芬與他莫昔芬療效相同,長期隨訪發現他莫昔芬獲益(特別是停藥后的獲益)更大[100],但還沒有數據比較依西美坦或阿那曲唑(AIs)與他莫昔芬或雷洛昔芬的獲益和風險。本指南認為,對大多數絕經后患者來說,他莫昔芬是最佳選擇,但需結合子宮存在情況及合并癥進行個體化選擇:(1)考慮到他莫昔芬對子宮內膜的刺激,有子宮者更可能首選雷洛昔芬;(2)考慮到他莫昔芬會增加白內障風險,有白內障風險的患者也可能首選雷洛昔芬;(3)考慮到AIs會增加骨量減少/骨質疏松風險,基線評估BMD低者首選雷洛昔芬;(4)考慮到血栓風險,有血栓病史者或血栓風險高者禁用他莫昔芬或雷洛昔芬,更可能選擇AIs;(5)考慮到致畸風險,妊娠或可能妊娠者禁用他莫昔芬和雷洛昔芬。
對于BRCA1/2或其他致病突變攜帶者,現有數據較少。對于BRCA1/2攜帶者,有數據顯示他莫昔芬用于BRCA2攜帶者可能有獲益;僅有回顧性數據表明,攜帶BRCA1/2突變的雌激素受體(estrogen receptor,ER)陽性乳腺癌患者使用AIs進行輔助治療能降低對側乳腺癌風險。而對于PTEN突變攜帶者,考慮到該突變所致的Cowden綜合征與子宮內膜癌風險增加相關,應慎用他莫昔芬,且使用時需溝通子宮內膜癌的風險問題。
4.3.3 藥物治療期間及結束后的管理
使用風險降低藥物期間應注重嚴重并發癥的監測:(1)有完整子宮者使用他莫昔芬時應進行常規適齡婦科篩查[《中國抗癌協會乳腺癌診治指南與規范(2021年版)》[115]建議使用婦科體格檢查結合子宮超聲檢查來共同評估];(2)使用AIs者應進行BMD監測;(3)使用SERMs者如出現血栓栓塞性疾病的相關癥狀應及時就診;(4)使用他莫昔芬者如有白內障或其他視力問題應進行眼科檢查等。此外,使用他莫昔芬者在完成5年療程后,應繼續監測后期毒性,尤其是子宮內膜癌和白內障。在治療過程中和治療結束后,如出現不良反應均應及時進行處理。
4.4 風險降低手術治療的管理
4.4.1 風險降低手術前后的管理
對于符合RRM手術指征、擬行RRM 的乳腺癌高危人群,應及早溝通并持續關注由于乳腺切除帶來的潛在社會心理影響[124],包括對自我身體形象的認同感、新建人際關系的難度以及現有人際關系的質量等帶來的負面影響,必要時進行心理咨詢。本指南建議:擬行RRM術前應進行多學科會診(應包括熟悉良惡性乳腺疾病自然病程和治療的外科醫生)[125],使個體充分了解降低乳腺癌風險可選治療方式、RRM的風險與獲益、保留乳頭的選擇以及乳房重建的選擇等。
對于考慮RRSO的BRCA1/2突變攜帶者,應充分溝通術中和術后的潛在風險,并積極地進行術后管理,包括但不限于:(1)手術本身相關的并發癥;(2)過早絕經相關的骨質疏松癥和心血管疾病風險增加;(3)圍絕經期癥狀,如骨質流失加速、血管舒縮癥狀、可能的認知變化等對生活質量的潛在影響。HRT能改善RRSO術后過早絕經相關的困擾,但是否會再次增加乳腺癌風險還存在爭議。如前所述,絕經后女性使用HRT可能會增加乳腺癌風險(詳見1.2.3)[46-49];然而,也有研究[126]顯示,RRSO術后短期使用任何類型HRT(包括單用雌激素、孕激素±雌激素等)都不會影響RRSO相關的乳腺癌風險降低。對此,NCCN專家組的共識是易感基因P/LP突變攜帶者RRSO術后仍應慎用HRT。
4.4.2 風險降低手術的選擇
除乳腺癌和卵巢癌風險均高的易感基因P/LP突變(如BRCA1/2等)攜帶者可能會考慮RRSO以外,其他考慮通過手術預防乳腺癌的高危人群通常建議選擇RRM。而對于BRCA1/2突變攜帶者,有Monte Carlo模擬模型(詳見指南中表2)分別評估了BRCA1或BRCA2突變攜帶者在不同年齡接受RRM和(或)RRSO后70歲時的生存概率[127]。從該模型的評估結果來看, BRCA1/2突變攜帶者單獨接受RRSO或RRM都能提升70歲時的生存概率(60%~70%),若RRSO配合RRM或乳腺篩查更能大幅提升70歲時生存概率(70%~80%)[127]。指南認為,BRCA1/2突變攜帶者選擇RRSO和(或)RRM時,可使用上述模型輔助決策,但仍主要取決于患者個人看法[128]。
5 總結
目前,我國乳腺癌高危人群的評估和錨定尚缺乏切實可行的系統性策略和辦法,更多地依賴于個體自主的機會性篩查,接受規范的風險降低管理更是尚無良方,多數高危人群并沒有獲得合適的降低風險的指導和管理,更談不上接受恰當的風險降低治療。本文對《NCCN乳腺癌風險降低指南(2023年版)》進行解讀,結合亞洲女性的乳腺特點以及我國乳腺癌的疾病現狀,將乳腺癌風險評估和風險降低管理過程進行歸納整理,探討了適合我國人群的乳腺癌風險降低管理流程,旨在為我國乳腺癌高危人群健康管理提供更科學準確的風險管理參考。我們建議:全社會積極宣傳乳腺癌風險主動管理的重要性,鼓勵高危人群定期篩查,并在專業醫生指導下接受必要的降低風險治療;提倡健康的生活方式,注重不良環境因素對乳腺癌發病的潛在影響,尤其是4個敏感窗口期的乳腺癌風險防控管理;同時,提高各級醫療機構從業人員對乳腺癌風險評估和管理的認識水平,利用新興的科技手段提升乳腺疾病群體篩查的同質化水平和質效,從而降低乳腺癌的發病率,促進“健康中國2030”的實現。
利益沖突:無。
作者貢獻:郭心怡進行文獻檢索和閱讀,論文撰寫和修改,圖表繪制,并對文章負責;呂青指導論文撰寫與修改,進行質量控制及審校。
乳腺癌是全球最常見的、女性致死人數最多的惡性腫瘤[1]。據估計,2020年全球新發乳腺癌約226萬例,約68萬人死于乳腺癌[1];其中,我國新發乳腺癌達41萬例,約占全球的1/5[1],且自1990年以來,我國乳腺癌發病率的增長速度達到全球的兩倍以上,乳腺癌正嚴重威脅著我國女性的身體和心理健康,給社會公共衛生體系帶來巨大負擔,實現有效的乳腺癌防控已成為我國亟待解決的一大難題,因此,制定有效的乳腺癌風險評估方案、實施可靠的乳腺癌風險降低策略勢在必行。
2022年10月美國國家綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)更新了2023年版的《NCCN乳腺癌風險降低指南》,針對沒有浸潤性乳腺癌或導管原位癌(ductal carcinoma in situ,DCIS)病史的人群,為臨床醫生提供具有規范化指導意義的乳腺癌風險評估方案和風險降低策略。盡管我國與西方人群在種族、生活環境、生活方式等風險因素以及乳腺癌患者的臨床特點和病理特征等諸多方面存在差異,西方國家制定的風險評估模型在我國的應用價值也有限,但是我國在乳腺癌預防和控制方面明顯滯后于西方發達國家,我國作為乳腺癌的主要發病大國之一,該指南仍能為我國的乳腺癌風險降低戰略提供重要參考依據和借鑒價值。
為幫助我國醫生針對乳腺癌高危人群應用個性化策略降低乳腺癌風險,本文將結合亞洲女性的乳腺結構特點以及我國乳腺癌的流行病學特點,從乳腺癌的風險因素、風險評估模型、降低風險的干預措施以及干預相關的不良反應4個方面分別對該指南進行解讀,并對乳腺癌高危人群識別與管理的全流程進行梳理,旨在為我國乳腺癌防控事業的落地實施尋求有價值的啟發和借鑒。
1 乳腺癌的風險因素
乳腺癌的發病風險因素包括家族/遺傳風險因素和個人風險因素兩大類,但真實世界中僅有10%~15%的乳腺癌發病可歸因于遺傳因素,而絕大部分乳腺癌的病因尚不完全明確,可能是多種風險因素共同影響[2]。由于我國種族特征、經濟發展、生活方式等與西方國家有所不同,因而風險因素與乳腺癌發病率之間的關聯可能與西方國家存在細微差異,但大部分的風險因素相似[3-4]。
1.1 家族/遺傳風險因素
根據世界衛生組織(World Health Organization,WHO)2020年的數據,中國女性終身的乳腺癌發病風險約為5.3%[1]。然而某些與乳腺癌風險密切相關的高外顯率基因發生致病/可能致病(pathogenic/likely pathogenic,P/LP)的突變時,會將突變攜帶者的終身乳腺癌風險提高至20%~60%以上,特別是許多與標志性遺傳性疾病相關基因的P/LP突變會大幅提高攜帶者的終身乳腺癌風險(表1),包括遺傳性乳腺癌和卵巢癌相關的乳腺癌易感基因1/2(BRCA1/2)[5-7]、李法美尼綜合征(Li-Fraumeni syndrome,LFS)相關的TP53基因[7-8]、考登綜合征(Cowden syndrome)/張力蛋白同源的第10號染色體缺失的磷酸酶(PTEN)錯構瘤綜合征(PTEN hamartoma tumor syndrome,PHTS)相關的PTEN基因[7, 9]、遺傳性彌漫性胃癌相關的上皮-鈣粘連素1(CDH1)基因[7, 10]以及Peutz-Jeghers綜合征相關的絲氨酸-蘇氨酸激酶11(STK11)基因[7, 11]等。此外,還有許多缺乏標志性遺傳病的基因P/LP突變也會不同程度地提高乳腺癌風險,如乳腺癌易感基因相關蛋白2(PALB2)、共濟失調毛細血管擴張突變(ATM)、BARD1、檢查點激酶2(CHEK2)、神經纖維瘤病1型(NF1)、RAD51C或RAD51D基因等[7]。攜帶上述基因P/LP突變的個體均視其具有已知的乳腺癌遺傳易感性。在我國乳腺癌患者中,BRCA1和BRCA2基因P/LP突變發生率分別約為1.9%和2.1%[12],而TP53、PTEN、STK11、CHEK2、NF1等基因的P/LP突變率約為0.18%~0.44%[13]。
對于上述基因P/LP突變未知的個體,則需要使用乳腺癌的家族/遺傳風險標準[7]進一步評估乳腺癌的遺傳易感性。該標準主要考慮以下因素:(1)家族中是否有上述遺傳基因P/LP突變攜帶者,這些基因突變多表現為常染色體顯性遺傳模式,攜帶者的子女有50%的概率遺傳其突變[7];(2)經模型(如BRCAPro模型、CanRisk工具等)預測個體攜帶BRCA1/2致病突變的概率;(3)個體或家族中是否有LFS、考登綜合征/PHTS等病史[7];(4)個體或家族中是否有卵巢癌(特別是上皮性卵巢癌)[14]、胰腺癌(特別是外分泌胰腺癌)[15-16]、前列腺癌、結直腸癌或彌漫性胃癌等癌癥病史;(5)家族中是否有乳腺癌病史,包括乳腺癌確診年齡、病理組織學類型[17-19]、是否男性乳腺癌[20];(6)家族中是否有德系猶太人血統[21-22]等。由于該標準較為復雜,本文僅將其整理概括為圖1(具體詳見《NCCN遺傳/家族風險評估指南:乳房和卵巢》[7])。滿足≥1條標準者攜帶乳腺癌易感基因P/LP突變的概率增加,因而患家族性/遺傳性乳腺癌的風險可能增加,視為具有家譜提示的乳腺癌遺傳易感性,本指南建議進行正式的遺傳評估和咨詢(包括可能的基因檢測等)進一步明確乳腺癌風險。
 圖1
針對沒有浸潤性乳腺癌/DCIS病史人群的家族/遺傳風險標準[7]
圖1
針對沒有浸潤性乳腺癌/DCIS病史人群的家族/遺傳風險標準[7]
DCIS:導管原位癌;P/LP:致病/可能致病;*與乳腺癌相關的遺傳性疾病包括Li-Fraumeni綜合征、Cowden綜合征/PTEN錯構瘤綜合征(PHTS);#對于胰腺癌或前列腺癌,只考慮一級親屬的家族史;△基于BRCAPro、CanRisk等模型的預測結果
1.2 個人風險因素
目前較為公認的影響乳腺癌風險的因素較多,結合指南將其歸為以下5類(表2)。
1.2.1 人口學因素
人口學因素包括性別、年齡、民族/種族等。研究[21-22]顯示,女性是乳腺癌的主要受累群體;而德系猶太人中較高的BRCA1/2突變率可能增加乳腺癌風險,常見致病突變BRCA1 185delAG和BRCA2 6174delT的突變概率分別約為1.09%和1.52%,而這些突變在美國人群中的發生率至少<0.1%。此外,隨著年齡增加乳腺癌風險也逐步增加,由≤49歲時的1.9%增加到≥70歲時的6.7%,這可能與年齡增加所致的染色體穩定性下降、免疫系統功能衰退等有關[23]。然而,與西方國家相比,我國乳腺癌發病呈現年輕化:美國的乳腺癌發病高峰為55~64歲[24],而我國呈現雙峰分布,主要發病高峰為45~55歲,較西方國家更加年輕[25],確診時≥65歲的乳腺癌患者僅有23.6%(美國有46.5%)[1]。我國乳腺癌相對年輕化的特定發病峰值可能與出生隊列效應有關,考慮源于特定時期出生人群的月經和生殖模式以及其他生活方式和環境因素等的變化[26]。與2008年相比,我國乳腺癌的確診年齡正在逐步向后推移,并且根據預測模型的分析還將繼續后移[27]。
1.2.2 生殖相關內源性雌激素暴露因素
目前認為,月經初潮早(≤12歲)[28-29]、未產[28]、初次活產年齡晚(≥35歲)[28]、絕經年齡晚(≥55歲)[28]會增加乳腺癌風險;而絕經早(<45歲)[28]、母乳喂養[30]會降低乳腺癌風險,終身母乳喂養時間越長乳腺癌風險越低。在中國人群中發現,終身生育數量下降可能通過影響上述因素(如縮短終身哺乳時間)而增加乳腺癌風險[31]:由于我國生育政策推行和經濟水平逐步提高,中國的總生育率(每名女性的平均生育數量)從上世紀50年代的6.0下降到2010年的1.6,這一趨勢在經濟較為發達的東部沿海地區(特別是上海市)尤為明顯[27];而與之相伴的是,中國女性的乳腺癌發病率也迅速上升[1],從1988年的27.6/10萬到2008年的43.9/10萬[32],以東部沿海城市地區最高,2008年達46.35/10萬[33]。此外,針對中國人群的研究還發現流產次數≥3次[34]、月經周期不規律[35]等因素可能也與乳腺癌的發病有關。
1.2.3 生活方式因素
(1)絕經后體重指數(body mass index,BMI)是乳腺癌的獨立危險因素。絕經后超重(BMI 25~30 kg/m2,我國人群BMI 24~28 kg/m2)或肥胖(BMI>30 kg/m2,我國人群BMI>28 kg/m2)會增加絕經后乳腺癌風險[36-37], BMI≥25.9 kg/m2者乳腺癌風險約為BMI<20.5 kg/m2者的2.54倍[36],特別是激素受體陽性型乳腺癌[38],這種關聯可能歸因于脂肪組織來源的循環內源性雌激素水平增加[36]。研究[39]表明,在中國女性中BMI對乳腺癌風險的影響更大,無論是否絕經,超重或肥胖者乳腺癌風險增加4倍。隨著我國傳統飲食模式向西方飲食模式的轉變(即快餐文化的普及)[40],越來越多成年女性(32.1%)甚至是青少年(28.7%)處于超重甚至肥胖狀態[27],這一趨勢可能也是我國乳腺癌發病率逐漸增加的原因之一。
(2)酒精攝入與乳腺癌風險增加有關,每天每攝入10 g酒精,乳腺癌風險增加約10%[41-43],即使輕度酒精攝入也會使乳腺癌風險顯著增加5%[44]。酒精作為輔助致癌物,可能通過提高細胞膜對致癌物的通透性、抑制致癌物的解毒作用等提高乳腺癌風險[42]。
(3)當前或既往雌/孕激素使用也可能增加乳腺癌風險。年輕女性使用口服避孕藥可能增加乳腺癌風險,且持續時間越長乳腺癌風險越高[45]。絕經后女性接受激素替代治療(hormone replacement therapy,HRT)也可能增加乳腺癌風險:隨機對照試驗[46]顯示,有完整子宮者接受雌激素+孕激素治療期間乳腺癌風險約增加62%~91%,治療停止后1年內增加的風險迅速下降至正常;觀察性研究[47-49]顯示子宮切除術后患者在絕經時或更早即開始單用雌激素治療也會使乳腺癌風險增加30%~42%;而隨機對照試驗[50]顯示,絕經后數年開始接受雌激素治療似乎不增加乳腺癌風險,甚至使乳腺癌風險降低23%[51]。對此可能的解釋是,一段時間雌激素剝奪后短期使用雌激素可能會通過誘導隱匿性乳腺癌的腫瘤細胞凋亡來降低乳腺癌風險,而長期持續使用雌激素可能會引發和促進新腫瘤的生長,從而增加乳腺癌風險[52]。然而,激素宮內節育器(intrauterine devices,IUDs)的激素全身吸收非常少,乳腺癌風險增加較少(16%~21%)[53-54]。由于我國人群對用藥(特別是激素類藥物)的排斥心理,目前使用雌/孕激素藥物的現象在我國并不算多見,但隨著當代年輕人思想逐漸開放,加之絕經后雌激素補充有益于提高女性生活質量和維護心血管及骨健康,未來對我國乳腺癌發病的影響仍不容小覷,使得我們面臨的問題更加復雜,如何權衡絕經后HRT的利弊將成為新的課題。
(4)當前或既往吸煙也能使乳腺癌風險分別增加24%和13%,特別是吸煙起始年齡較小者。Meta分析[55]結果顯示,月經初潮前或初潮后但距離初次生育≥11年即開始吸煙使乳腺癌風險分別增加61%和45%,可能的原因是乳腺組織直到初次妊娠完成才發育完全,在此之前的乳腺生長發育期對尼古丁、焦油等基因毒性物質的暴露更敏感[56]。
(5)運動也能在一定程度上降低乳腺癌風險。Meta分析[57]顯示,每周進行≥150 min的劇烈運動能使乳腺癌風險降低9%,這可能與運動通過減少脂肪組織從而降低脂肪組織來源的雌激素有關[58]。而我國人群普遍缺乏運動,平均運動量遠低于西方國家水平,但隨著近年來逐漸意識到運動對于健康的重要性,越來越多的人加入健身行列,我國的運動情況在未來幾十年可能會逐步得到改善。
(6)乳腺癌風險降低藥物的既往用藥史與乳腺癌風險降低有關(詳見3.2)。目前的風險降低藥物主要通過干擾雌激素的合成或作用機制從而降低乳腺癌風險,如他莫昔芬和雷洛昔芬等雌激素受體調節劑(selective estrogen receptor modulators,SERMs)通過與雌激素受體結合而阻礙雌激素發揮作用[59],依西美坦和阿那曲唑等芳香化酶抑制劑(aromatase inhibitors,AIs)通過抑制芳香化酶作用而降低外周組織的雌激素合成[60]。然而,目前乳腺癌高危人群使用風險降低藥物預防乳腺癌的現狀并不樂觀。國外研究[61]顯示只有44%的非典型增生(atypical hyperplasia,AH)/小葉原位癌(lobular carcinoma in situ,LCIS)患者接受風險降低藥物治療;而我國醫生(特別是基層醫生)對乳腺癌高危人群藥物預防的認識程度非常不足,加之國民對藥物不良反應的恐懼心理和服藥的排斥心理,致使用藥的依從性極差,盡管沒有確切數據,但現實觀察可見我國乳腺癌高危人群接受藥物預防的比例只會更小。
(7)本指南沒有提及的精神心理因素也可能是乳腺癌的風險因素[62],特別是對于中國女性[63],如不良情緒、情緒調節能力差、不良生活事件或缺乏社會心理支持等都可能增加乳腺癌風險[62-63]。隨著我國(特別是東部沿海城市)經濟水平的迅猛發展,工作壓力增加帶來不良情緒增加的同時又降低了情緒調節能力,以工作為重心的生活方式繼發社交生活匱乏以及社會心理支持不足,這可能也是近年來我國(特別是東部沿海城市)乳腺癌發病增加的原因之一。
1.2.4 乳腺相關病史因素
(1)乳腺增殖性病變背景。扁平上皮異型性(flat epithelial atypia,FEA)與無異型性的良性增殖病變對乳腺癌風險影響不大;而有異型性的增殖病變,包括AH[含非典型導管增生(atypical ductal hyperplasia,ADH)和非典型小葉增生(atypical lobular hyperplasia,ALH)][64]和LCIS[65],與乳腺癌風險增加有關。其中ADH者和ALH者的乳腺癌風險分別為良性非增殖性乳腺疾病者的2.4倍和5.3倍[64],而LCIS者乳腺癌風險大幅增加,其10年和20年乳腺惡性腫瘤的累積發病率分別為11.3%和19.8%[65]。
(2)既往乳腺活檢病灶數量,包括切除活檢、粗針活檢或細針穿刺(fine-needle aspiration,FNA),同一病灶的多次活檢按單個活檢計,數量越多乳腺癌風險可能越高。
(3)乳房X線檢查的乳腺密度(腺體和纖維組織體積/乳房總體積),包括乳腺密度不均(c型,乳腺密度51%~75%)和(或)致密乳腺(d型,乳腺密度>75%),特別是致密乳腺越來越被認為是乳腺癌的重要危險因素,其乳腺癌風險約為乳腺密度<10%者的4.7倍[66]。雖然亞洲女性乳房普遍更為致密(c型56.09%,d型27.13%)[67],但在我國似乎并未發現乳腺密度與乳腺癌風險的關聯[68-69]。
(4)有<30歲時的胸部/乳房放射治療(radiation therapy, RT)史,如<16歲時接受過胸部RT治療霍奇金淋巴瘤后的幸存者成年后乳腺癌風險明顯增高,其相對風險在治療后10~14年時為71.3,15~19年時達到90.8,隨后緩慢下降[70]。
1.2.5 環境因素
本指南并未涉及的環境因素也是近年的研究熱點之一。除了內源性雌激素暴露,女性一生中還有更為復雜的外源性內分泌干擾物(endocrine-disrupting chemicals,EDCs)和其他環境致癌物的暴露,后者也是導致乳腺癌發病率增加的重要原因之一[71]。多項研究結果表明,EDCs對內環境的干擾已經成為一個重要的公共問題。美國內分泌協會(The Endocrine Society,TES)于2009年發表的第一份關于EDCs對人類疾病發展作用的科學聲明(稱為“EDC-1”)[72]指出,EDCs代表一大類化學物質,廣泛存在于自然環境或食品用品中,如植物殺蟲劑或除草劑(有機氯類等)、化工原料(塑料、橡膠等)、金屬材料等,其中最主要的為環境雌激素(environmental estrogens,EEs),其可通過干擾內源性激素的生物合成、作用機制或代謝途徑,破壞體內正常的激素調節過程,引發生殖調控的紊亂。
研究[73-75]發現,EEs對乳腺癌風險的影響在女性一生中乳腺發育的4個敏感窗口期最為顯著,包括:產前期(胎兒期)、青春期、懷孕期和更年期。目前與乳腺癌相關性較高的三種常見EEs分別是:(1)雙酚A(bisphenol A,BPA)廣泛用于罐頭或飲料包裝、水瓶等塑料制品中;(2)鄰苯二甲酸酯(phthalates,PAEs),作為增塑劑多存在于塑料制品、化妝品、裝修涂料、香味產品(香水等)中;(3)多氯聯苯(polychlorinated biphenyls,PCBs),常作為添加劑存在于橡膠、潤滑油、防火劑等[76]。當代年輕人工作繁忙,長期頻繁食用塑料包裝的各類食品,富含油脂的高溫飯菜更易溶解塑料包裝(特別是不合格餐盒)中的多種EEs,EEs多為脂溶性,進入體內代謝非常緩慢,攝入后在體內長期累積,可能導致乳腺癌風險增加等健康隱患,這或將成為我國乳腺癌防控中新的巨大挑戰。
2 乳腺癌風險的評估
盡管對乳腺癌發病風險因素的研究眾多,但是乳腺癌發病仍然是一個綜合、復雜和未知的過程,如何評估個體的乳腺癌發病風險一直是研究的熱點和難點,也是目前乳腺癌防控的重要切入點。目前,乳腺癌風險預測模型是最公認的個體乳腺癌風險評估方法,但是,迄今為止,沒有一個模型能夠完整納入所有的乳腺癌風險因素,對乳腺癌風險進行全面且充分的評估;也還沒有一個模型能夠良好預測所有人種的乳腺癌患病風險。本指南推薦的乳腺癌風險評估模型包括:改良Gail模型、國際乳腺癌干預研究(International Breast Cancer Intervention Study,IBIS)/Tyrer-Cuzick模型、乳腺癌監測聯盟(The Breast Cancer Surveillance Consortium,BCSC)風險計算器2.0版、BRCAPro模型和CanRisk工具,均可在線使用。其中,后兩者能評估個體攜帶BRCA1/2基因P/LP突變的風險。
2.1 改良Gail模型
改良Gail模型是目前最為經典的乳腺癌風險評估模型。該模型納入7項風險因素,包括:年齡、種族、月經初潮年齡、初次活產年齡或未產、患乳腺癌的女性一級親屬人數、既往乳腺活檢的良性病灶數量、活檢組織學檢查是否診斷AH。該模型能夠對個體5年和終身乳腺癌風險進行評估[77],5年風險≥1.7%者通常視為乳腺癌高危人群,本指南認為可以考慮使用藥物降低乳腺癌風險,而5年風險≥3%者本指南則推薦使用藥物降低乳腺癌風險。但該模型對家族史的評估不夠全面,且僅適用于≥35 歲人群,不適用于有FEA的個體。該模型用于以下人群時可能低估其風險:(1)已知的乳腺癌遺傳易感性基因突變攜帶者,如BRCA1/2、TP53、PTEN等;(2)有明顯的乳腺癌家族史者;(3)有卵巢癌家族史者;(4)有AH或LCIS者;(5)既往接受了胸部RT者。
2.2 IBIS/Tyrer-Cuzick模型
該模型是主要依賴家族史的乳腺癌風險評估模型,與改良Gail模型相比更復雜但更全面。該模型全面納入家族史和整體家族結構,同時結合BRCA1/2基因檢測結果、個體卵巢癌病史以及個人風險因素,更加充分地評估10年和終身乳腺癌風險[78]。10年風險≥5%者通常視為乳腺癌高危人群,本指南推薦使用藥物降低乳腺癌風險,而對于剩余終身風險≥20%者本指南視其為具有模型提示的乳腺癌遺傳易感性。其中,對家族史的評估包括一、二、三級親屬是否確診乳腺癌或卵巢癌、是否存在BRCA1/2基因突變;納入的個人風險因素包括年齡、種族、生殖相關因素(月經初潮年齡、初次活產年齡、絕經年齡)、BMI、HRT的持續時間、乳腺活檢史和結果(含AH或LCIS)、乳腺密度等[78]。該模型適用人群年齡段更寬,可用于<35歲的女性,但仍未考慮胸部RT的影響,且該模型用于以下人群時可能高估其風險:(1)西班牙裔個體;(2)有AH或LCIS者;(3)致密乳腺者。
2.3 BCSC風險計算器 2.0 版
該模型結構簡單、評估過程迅速,僅納入了5個因素,包括年齡、種族、女性一級親屬的乳腺癌家族史、乳腺活檢史和結果(含AH或LCIS)、乳房X線檢查的乳腺密度BI-RADS分類,能夠對5年和10年乳腺癌風險進行評估,同時展示同年齡同種族女性5年和10年的乳腺癌平均風險供使用者參考[79]。但該模型在家族史、遺傳易感性基因突變方面與改良Gail模型有著相似的局限性,并且僅適用于35~74歲人群,不適用于有乳腺癌、DCIS、隆胸術或乳腺切除術既往史的個體。
2.4 BRCAPro模型
該模型也是主要依賴家族史的乳腺癌風險評估模型。該模型基于一、二級親屬的乳腺癌和卵巢癌家族史,將無病史的親屬與SEER數據進行比較,能通過計算BRCA1/2 基因的單個和組合概率,繼而預測個體乳腺癌風險。但該模型可能會低估卵巢癌或前列腺癌家族的攜帶頻率,且未考慮其他乳腺癌遺傳易感性基因,也未納入三級親屬。
2.5 CanRisk工具
該模型是基于家族史和中高風險乳腺癌/卵巢癌易感基因(包括BRCA1/2、PALB2、CHEK2、ATM、BARD1、RAD51C 和 RAD51D)變異的綜合模型,復雜而龐大,結合直系/遠親的乳腺癌/非乳腺癌家族史、常見的中高風險易感基因變異[總結為多基因風險評分(polygenic risk scores,PRS)]、生活方式和激素暴露、乳房X線檢查的乳腺密度等信息,預測上述中高風險易感基因P/LP突變(包含單核苷酸多態性(single nucleotide polymorphisms,SNPs)的攜帶概率以及未來的乳腺癌和卵巢癌風險。然而,該模型仍有未考慮到的個人風險因素,如母乳喂養、既往乳腺活檢和異型性增殖病變、胸部RT等,并且本指南不鼓勵在風險評估中常規使用PRS。
但這些模型均是基于西方人群建立的,在我國人群中的應用價值可能有限。目前最為常用的兩大模型改良Gail模型和IBIS/Tyrer-Cuzick模型在中國女性中預測5年乳腺癌風險的曲線下面積僅分別為0.665和0.786[80]。因此,在西方國家廣泛推崇的模型對于我國女性乳腺癌風險具有一定的預測能力,但準確性不足[81],這可能是由于我國與西方國家的乳腺癌風險因素存在差異,如我國女性乳房體積更小更致密、乳腺癌發病年齡更早等[82-83],導致模型納入的危險因素及其所占權重并不完全適用于我國女性。研究證實,結合了遺傳風險因素的IBIS/Tyrer-Cuzick模型在中國女性中的預測效果較Gail模型更好[84];而將Gail模型結合我國乳腺癌風險因素特點,包括我國個性化的流行病學特點[63]和影像學因素(超聲[85]、X線[86])等,其預測效果也有所提高。另外,上述乳腺癌風險預測模型均未納入環境因素,而近年來越來越多的研究開始發現并重視不良環境因素的長期暴露會導致乳腺癌發病風險升高和發病提前,作為發展中國家,我國的EEs暴露問題可能更加嚴峻。因此,我們需要在經典模型的基礎上結合中國實際情況,逐步構建適合中國女性的乳腺癌風險評估模型。
同時,西方國家醫療負擔適度,平均每千人擁有的醫生數量更多,就診評估模式更為精細全面,醫生更傾向使用風險評估模型對個體的風險進行全面的評估。然而,我國醫療負擔較重,平均每千人擁有的醫生數量不足,診療任務超負荷,門診就診節奏快,缺乏充足的時間關注疾病預防,而專業的疾病防控人員也嚴重不足,因此太多太復雜的風險評估模型無法在真實世界中得到應用。雖然西方模型在我國的應用價值可能有限,但具有中國特色的模型構建還需要時間,且模型也不是評估乳腺癌風險的唯一標準,因此就目前的情況,我們仍然建議可考慮在我國選擇兩個經典模型配合其他風險評估策略進行人群乳腺癌風險的初篩,其中首選簡單快捷的改良Gail模型和主要依賴家族史的IBIS/Tyrer-Cuzick模型,而網頁版使用略顯不便,最好能開發手機軟件或微信小程序等快速評估手段;同時我們建議加強我國人群乳腺癌風險預測模型的研究,包括考慮納入外源性EEs暴露等風險因素,以便較準確地錨定真正的乳腺癌高風險人群,更為精準地實施預防管理,降低社會成本,有效降低我國乳腺癌發病率。
3 降低乳腺癌風險的干預措施
基于上述乳腺癌風險因素,采取相應的干預措施,尤其是對乳腺癌高危人群進行合理而恰當的干預,有望降低乳腺癌發病率。目前較為公認的降低乳腺癌風險的主要干預措施有:生活方式、藥物預防、手術預防。
3.1 改變生活方式
盡管改變生活方式與乳腺癌風險之間的關聯尚不完全明確,但本指南仍然推薦可能降低乳腺癌風險的健康生活方式:(1)使用雌/孕激素聯合藥物≥3~5 年可能與乳腺癌風險增加有關,指南建議乳腺癌高危人群應慎用雌/孕激素,特別是絕經后應慎用HRT,并且反對在服用風險降低藥物預防期間使用HRT。(2)任何酒精攝入都會增加乳腺癌風險,指南建議最好避免酒精攝入,而飲酒人群應將飲酒量限制在每天≤1杯,每周≤3杯(1杯的定義約為28 g白酒、170 g葡萄酒或226 g啤酒)。(3)超重或肥胖者有更高的絕經后乳腺癌風險,指南建議將BMI控制在20~25 kg/m2(對于我國人群可能需控制在20~24 kg/m2)有助于降低乳腺癌風險。(4)增加軀體運動水平與乳腺癌風險降低有關[87],指南建議,每天加強運動,避免久坐不動,每周參加≥150 min的中等強度體育活動。(5)一些證據表明,富含水果和蔬菜的飲食結構可以降低乳腺癌風險[88],維生素D(包括食物和皮膚來源)也可能對乳腺癌風險有保護作用[89]。(6)鼓勵適當改變可能具有保護作用的其他因素,如:盡可能在年輕時初次分娩、提倡母乳喂養等。(7)本指南沒有提及的精神心理因素也可能與乳腺癌風險有關,我們建議可適當進行冥想、瑜伽等放松身心的活動調節情緒,遇事尋求家人朋友的幫助,合理釋放不良情緒、應對不良生活事件,必要時尋求社會心理支持。(8)EEs可能增加乳腺癌風險,我們建議盡可能減少加工食品(尤其是肉制品)的攝入,進食天然新鮮烹飪的食物;盡量避免使用塑料制品盛裝高溫食物和飲料;減少攝入脂肪含量高的動物食品及腌臘燒烤等。
3.2 降低乳腺癌風險的藥物
現有的降低乳腺癌風險的藥物包括兩類:(1)SERMs,包括他莫昔芬和雷洛昔芬;(2)AIs,包括依西美坦和阿那曲唑(表3)。屬于乳腺癌一級預防的范疇,也稱藥物預防。但風險降低藥物在<35歲人群中的效用尚不清楚,目前僅適用于≥35歲人群。除他莫昔芬可用于絕經前人群外,其他藥物僅適用于絕經后人群。
3.2.1 他莫昔芬
他莫昔芬是一種SERM,在乳腺癌輔助治療和轉移性乳腺癌解救治療中具有重要價值,用于乳腺癌的輔助治療能降低對側原發性乳腺癌風險[90]。研究顯示,他莫昔芬20 mg/d持續5年用于乳腺癌高危人群,可將5年內乳腺癌風險降低49%,有AH病史者可降低86%,有LCIS病史者降低56%[91],且停藥7年后仍能使乳腺癌風險降低43%[92]。因此,美國食品藥品監督管理局(Food and Drug Administration,FDA)批準他莫昔芬用于乳腺癌高危人群的藥物預防,本指南推薦的他莫昔芬標準用法是20 mg 1次/d(q.d.)持續5年。如標準劑量下出現嚴重副反應、不愿或無法服用標準劑量時,5 mg q.d. 持續3年的低劑量療程可作為備選[93]。雖然目前沒有使用他莫昔芬>5年的數據,但他莫昔芬停藥后長期獲益較好,本指南建議他莫昔芬用于降低乳腺癌風險時5年療程比較合適,不推薦使用>5年。使用他莫昔芬的風險包括:(1)增加子宮內膜惡性腫瘤(包括子宮內膜癌和子宮內膜間質肉瘤)的風險(詳見4.1)[91, 94];(2)增加血栓栓塞風險(詳見4.3)[91, 95-96],故禁用于有血栓病史者或血栓風險高者,包括有深靜脈血栓、肺栓塞、血栓性卒中、短暫性腦缺血發作、已知的遺傳性高凝狀態等病史者;(3)增加白內障的患病風險和手術風險(詳見4.4)[91];(4)可能具有致畸作用(詳見4.6)[97],妊娠或可能妊娠(在沒有有效的非激素避孕方法時)者禁用。
3.2.2 雷洛昔芬
雷洛昔芬是第二代SERM,與他莫昔芬具有相似的抗雌激素作用,但子宮內膜刺激明顯減少。雷洛昔芬降低乳腺癌風險的療效已在多項臨床研究中評估,雷洛昔芬60 mg/d持續5年用于乳腺癌高危人群能使5年內浸潤性乳腺癌風險降低44%[98],并且雷洛昔芬60 mg/d與他莫昔芬20 mg/d在5年治療期間降低乳腺癌風險的療效沒有顯著差異[99],加之雷洛昔芬對骨礦物質密度(bone mineral density,BMD)影響較小,故FDA批準其用于絕經后浸潤性乳腺癌高危人群(特別是患有骨質疏松癥者)的藥物預防,本指南中雷洛昔芬的推薦劑量為60 mg q.d.。然而,雷洛昔芬停藥后長期獲益會減少,研究[100]發現停藥3年后使用雷洛昔芬者的乳腺癌風險較使用他莫昔芬者高24%,本指南認為雷洛昔芬持續使用>5年可能是維持藥物風險降低活性的一種方法。使用雷洛昔芬的風險在于:(1)增加血栓栓塞風險(詳見4.3)[99, 101],故也禁用于有血栓病史者或血栓風險高者;(2)可能具有致畸作用(詳見4.6),妊娠或可能妊娠者禁用。
3.2.3 AIs
臨床試驗[102]證明AIs用于絕經后浸潤性乳腺癌患者的輔助治療能降低對側原發性乳腺癌風險,其效果可能優于他莫昔芬,尤其是對于首發乳腺癌為激素受體陽性的患者。而針對乳腺癌高危人群的隨機對照研究發現,使用依西美坦25 mg/d持續3年[103]或阿那曲唑1 mg/d持續5年[104]分別能使浸潤性乳腺癌風險降低65%[103]或53%[104]。基于上述結果,本指南將依西美坦25 mg q.d.和阿那曲唑1 mg q.d.作為絕經后個體降低乳腺癌風險的藥物選擇,但治療的最佳持續時間尚不清楚,且目前尚未獲得FDA批準。使用AIs的主要風險在于降低BMD(詳見4.2)[105-106],增加骨量減少/骨質疏松風險,從而增加骨折風險。
3.3 乳腺癌風險降低手術
目前,風險降低性乳腺切除術(risk-reducing mastectomy,RRM)也稱預防性乳腺切除術,是降低乳腺癌風險的主要手術方式,效果較為確切,能將BRCA1/2突變攜帶者[107]或有乳腺癌家族史者[108]的乳腺癌風險降低約90%。可選的手術方式包括保留/不保留乳頭的RRM,但無論哪種方式,乳腺切除術的完整性對于最佳風險降低效果至關重要。通常只有以下3種人群建議考慮RRM:(1)乳腺癌高風險基因P/LP突變(不包括意義不明確的突變)攜帶者,主要包括乳腺癌絕對風險>30%的7個基因BRCA1、BRCA2、TP53、PTEN、CDH1、PALB2或STK11[7];(2)有明顯的家族史者;(3)有<30歲時的胸部RT史者。而對于乳腺癌風險增加≥2倍的其他基因P/LP突變(基于大型流行病學研究)攜帶者,在缺乏明顯的乳腺癌家族史情況下,RRM的價值尚不清楚。接受RRM的女性可以選擇是否接受乳房重建手術,包括即刻或延遲乳房重建等。
風險降低性輸卵管卵巢切除術(risk reducing salpingo-oophorectomy,RRSO)主要用于降低個體卵巢癌風險,現有數據也較為支持RRSO用于絕經前女性能降低乳腺癌風險[7, 109-111]。研究[109]顯示,RRSO能使絕經前的BRCA1/2突變攜帶者術后乳腺癌風險降低54%,但對于>50歲女性RRSO降低乳腺癌風險的保護作用可能不再顯著。然而,也有少數研究[112]質疑RRSO降低乳腺癌風險的保護效應。因此,在目前的乳腺癌風險降低治療中,RRSO通常考慮用于乳腺癌和卵巢癌風險均高的基因P/LP突變(如BRCA1/2或PALB2等)攜帶者[7]。
3.4 乳腺癌藥物預防相關的不良反應及其監測與管理
針對乳腺癌高危人群使用藥物預防乳腺癌可能導致發生一系列不良反應的風險增加,然而,對沒有禁忌證的乳腺癌高危人群來說,降低乳腺癌風險的獲益通常超過增加不良反應風險的危害。因此,我們不能因噎廢食,不能因為對不良反應的過度恐慌而放棄乳腺癌的藥物預防,而是應當針對不同人群個性化挑選恰當的藥物,注重用藥期間對不良反應的監測與管理,為乳腺癌高危人群的藥物預防之路保駕護航。
3.4.1 泌尿生殖系統異常
他莫昔芬可能增加子宮內膜惡性腫瘤的風險[91, 94],特別是對于≥50歲人群侵襲性子宮內膜癌的風險增加3倍[91],其機制可能與他莫昔芬對子宮的雌激素激動劑活性有關[113]。但子宮內膜惡性腫瘤的絕對風險很低,對乳腺癌高危人群而言,乳腺癌風險降低的獲益通常超過子宮惡性腫瘤風險增加的危害。對于子宮完整人群,建議在使用他莫昔芬前進行基線婦科評估,并在治療過程中定期進行婦科評估。由于目前沒有足夠的證據推薦對無癥狀個體常規進行子宮超聲檢查或子宮內膜活檢[114],因而本指南認為主要采用婦科體格檢查進行婦科評估是合理的,但《中國抗癌協會乳腺癌診治指南與規范(2021年版)》[115]仍然建議使用婦科體格檢查結合子宮超聲檢查來共同評估。子宮內膜惡性腫瘤的早期典型表現為陰道點滴流血,對于出現異常陰道流血的絕經后個體,應暫停他莫昔芬并及時進一步評估。如發現早期子宮內膜惡變(包括異型增生、癌或肉瘤等),應盡快處理,可考慮在子宮切除術后重新使用他莫昔芬,本指南認為在完成早期子宮內膜癌治療后,恢復風險降低藥物治療是安全合理的;如未發現子宮內膜惡變,則繼續使用他莫昔芬,若癥狀持續存在或復發則需再次評估。
此外,由于雌激素水平下降或雌激素受體功能受抑制,使用風險降低藥物者可能會出現一系列泌尿生殖道癥狀,如陰道干燥、性交困難,以及尿痛、尿急等,可考慮局部使用非激素保濕劑或潤滑劑,或低劑量外用陰道雌激素(盡量避免使用生物同質激素或脫氫表雄酮),并且建議婦科就診。
3.4.2 運動系統異常
骨是一種雌激素反應性組織,乳腺癌藥物預防會給骨的生成與吸收過程帶來影響。研究發現,依西美坦[105]和阿那曲唑[106]都可能加速BMD降低,BMD降低可能進一步增加骨量減少/骨質疏松風險,是AIs治療者需要關注的重要問題。本指南建議絕經后患者在AIs 治療開始前使用雙能X射線吸收測定法(dual-energy X-ray absorptiometry,DEXA)掃描檢測基線BMD,并在治療過程中定期監測。對于接受AIs治療者,為改善BMD并降低骨折風險,結合《中國抗癌協會乳腺癌診治指南與規范(2021年版)》[115],我們建議:(1)進行適當運動,包括阻力運動和負重運動[116];(2)補充鈣和維生素D,國際骨質疏松癥基金會推薦絕經后女性每日攝入1 300 mg鈣和600 U維生素D,接受AIs治療者每日至少攝入800 U(≤2 000 U)維生素D[116];(3)每12個月監測BMD,必要時考慮使用雙膦酸鹽[口服(p.o.)/靜脈注射(i.v.)]或地舒單抗等藥物抑制骨吸收。基于目前的證據,唑來膦酸4 mg,i.v.,每6個月1次(q6mo)是防治AIs相關骨質流失的首選藥物,其他藥物如利塞膦酸鈉35 mg,p.o. ,每周1次或地舒單抗60 mg,皮下注射,q6mo等可酌情選用進行個體化治療[116]。
此外,使用依西美坦和阿那曲唑者可能會出現關節痛等關節癥狀,建議以對癥治療為主,可配合使用針灸、加強運動等,如癥狀持續存在并影響生活,可考慮更換另一種AIs或重新權衡使用風險降低藥物的獲益與風險。
3.4.3 血栓栓塞性疾病
他莫昔芬和雷洛昔芬可能會增加血栓栓塞風險,如靜脈血栓栓塞癥(venous thromboembolism,VTE)[包括深靜脈血栓形成(deep venous thromboses,DVT)和肺栓塞][91, 101]和卒中[95-96, 99]等。盡管如此,用藥后上述血栓栓塞事件的發生率分別都在每年0.1%左右[91],其絕對風險尚在可接受范圍內。由于針對血栓栓塞性疾病的間歇性篩查價值不大,對于服用他莫昔芬或雷洛昔芬的個體應注重宣教,包括交代血栓栓塞性疾病的相關癥狀,并告知長時間制動會進一步增加VTE風險等。本指南建議,對于接受他莫昔芬或雷洛昔芬治療的個體,如處于長時間制動狀態,應立即停藥,優先治療基礎疾病,待解除制動狀態后可繼續用藥,而確診血栓栓塞性疾病者應建議永久停用。
3.4.4 眼部病變
他莫昔芬可能會使白內障的患病風險和手術風險分別增加14%和57%[91]。此外,有案例研究[117]報道他莫昔芬可能與其他眼部病變的發生有關,包括結晶性視網膜沉積物、黃斑水腫、角膜改變或視網膜血管閉塞性疾病等。盡管如此,目前并沒有充分的證據表明他莫昔芬較輕的眼部毒性會限制該藥在乳腺癌預防和治療中的應用[91],但接受他莫昔芬治療時出現視覺癥狀的患者應尋求眼科評估。
3.4.5 潮熱
潮熱是一種常見的圍絕經期主訴,為血管舒縮功能不穩定所致。服用降低乳腺癌風險藥物可能增加潮熱的嚴重程度和/或頻率,其中服用他莫昔芬者(潮熱發生率可達81%)更明顯[91],但是有研究[118]指出使用他莫昔芬者出現潮熱或許可以預測藥物有效及獲益。出現潮熱的個體以對癥治療為主,而且,并非所有潮熱癥狀都需要醫療干預,隨著他莫昔芬用藥時間延長,潮熱癥狀可能自發減少[119]。只有當潮熱持續存在并影響生活質量時,才建議采取干預措施減少甚至消除潮熱,必要時重新權衡評估使用風險降低藥物的獲益與風險。
雌/孕激素雖然具有與SERMs相互作用的潛力,但有研究[120]顯示激素治療可能并不能改善他莫昔芬誘導的潮熱發生率,指南不建議在應用風險降低藥物期間使用雌/孕激素治療潮熱。研究[121]發現一些神經精神類藥物可能具有緩解潮熱的作用,包括加巴噴丁、文拉法辛和帕羅西汀,但仍需要在出現潮熱癥狀(尤其是同時服用他莫昔芬)的人群中評估這些藥物的長期有效性和安全性。有證據表明,某些選擇性5-羥色胺再攝取抑制劑(selective serotonin reuptake inhibitors, SSRIs),如帕羅西汀和氟西汀,可能干擾他莫昔芬向其活性代謝物(吲哚昔芬和4-OH他莫昔芬)的酶促轉化,降低后者的血漿水平,從而影響療效[121]。指南[121]建議使用他莫昔芬的個體需慎用這些藥物,盡可能選擇對吲哚昔芬血漿水平影響最小的藥物,如西酞普蘭和文拉法辛等。可能改善潮熱的其他藥物包括可樂定(口服制劑和透皮貼劑)和維生素E等,其他輔助措施包括放松訓練、針灸、運動、避免咖啡因和酒精等,但還缺乏充足的數據支持。
3.4.6 致畸作用
他莫昔芬[97]和雷洛昔芬都可能具有致畸作用,雖然由于證據有限尚且無法確定因果關系,但本指南仍然建議妊娠或可能妊娠(在無有效的非激素避孕方法時)者禁用他莫昔芬和雷洛昔芬,同時我們建議在停藥后3個月的藥物清除期內繼續進行非激素避孕[122]。
4 乳腺癌的風險管理
乳腺癌的風險管理工作需要針對不同人群制定個性化策略,涉及多層面多角度,內容繁復,亟需一套全面、詳細、清晰的風險管理策略指導我們高效、快捷、準確地制定個性化的乳腺癌風險管理方案。本文結合指南和相關文獻,對乳腺癌高危人群識別與管理流程進行梳理,并根據國情,提出對我國乳腺癌風險管理的一些建議,以期進一步推動我國的乳腺癌風險管理工作。
4.1 乳腺癌的風險評估
首先確認個體沒有浸潤性乳腺癌或DCIS病史,而后開始風險評估過程(圖2),旨在篩選出乳腺癌遺傳風險和(或)個人風險增加的個體。(1)首先評估個體是否攜帶已知的乳腺癌高風險基因的P/LP突變(表1):攜帶者視為具有已知的乳腺癌遺傳易感性;而未攜帶者(包括攜帶意義不確定變異者)或攜帶情況未知者,進一步評估遺傳風險。(2)進一步的遺傳風險評估,需全面評估家族史,判斷個體是否滿足乳腺癌的家族/遺傳風險標準(圖1,詳見指南[7])。滿足≥1條者建議轉診進行正式的遺傳評估和咨詢,包括可能的基因檢測等:基因檢測陽性者(即乳腺癌高風險基因P/LP突變攜帶者)視為具有已知的乳腺癌遺傳易感性;陰性者(即未攜帶者)或未檢測者視為具有家譜提示的乳腺癌遺傳易感性。(3)不滿足標準者、基因檢測陰性或未檢測者進一步評估個人風險因素,并使用風險評估模型綜合評估乳腺癌風險。(4)其中,主要依賴家族史的模型(IBIS/Tyrer-Cuzick等)可進行附加的家族風險評估,乳腺癌剩余終身風險≥20%者視為具有模型提示的乳腺癌遺傳易感性。
乳腺癌家族/遺傳風險增加人群即包括具有已知的、家譜提示的或模型提示的遺傳易感性的個體。而乳腺癌個人風險增加人群包括,(1)有AH/LCIS病史者;(2)有<30歲時胸部RT既往史者;(3)風險評估模型提示乳腺癌風險升高者,如改良Gail模型5年風險≥1.7%或IBIS/Tyrer-Cuzick模型10年風險≥5%的個體等。二者統稱為乳腺癌高危人群。
4.2 乳腺癌高危人群的管理
沒有乳腺癌病史的乳腺癌高危人群,只要有≥1個完整乳腺,都應該接受降低乳腺癌風險管理(圖3),推薦進行降低風險的咨詢,包括咨詢健康生活方式和降低風險選擇。預期壽命<10年者,指南不推薦風險降低治療或乳腺篩查,其獲益可能微乎其微,但推薦通過改變生活方式來降低乳腺癌風險。而預期壽命≥10年者,指南建議:(1)改變不良生活方式;(2)結合個人意愿與醫生共同進行風險降低決策討論;(3)無論是否接受風險降低治療,均應定期進行乳腺篩查。
 圖3
乳腺癌的風險降低管理流程圖
圖3
乳腺癌的風險降低管理流程圖
DCIS:導管原位癌;* 按照《NCCN乳腺癌篩查和診斷指南》[123]進行處理
具有乳腺癌高風險基因P/LP變異或相關遺傳性疾病者[7]以及其他高危人群[123]的乳腺篩查詳細策略應參照相應指南。通常來說,對于大部分高危人群,每6~12個月進行1次臨床乳房體格檢查,每年進行1次雙側乳房X線檢查,并提高乳腺監測意識;對于部分極高危人群(如剩余終身風險≥20%或有<30歲時的胸部RT史等),在此基礎上每年增加1次乳腺磁共振成像(magnetic resonance imaging,MRI)。由于亞洲女性的乳腺普遍較為致密,單獨依靠乳房X線檢查可能會遺漏可疑病變,對于我國人群,基于人群乳腺的結構特點和國情,結合我國指南[115],我們推薦在上述基礎上每6~12個月增加1次乳腺超聲檢查,尤其是對于40歲以下人群,可能乳腺超聲檢查優于X線檢查。
進行風險降低決策時,需注意以下幾點。(1)有AH/LCIS病史者,強烈推薦使用風險降低藥物,能大幅降低乳腺癌風險(AH者降低約86%,LCIS者降低約56%),特別是LCIS者,雖然以前建議考慮RRM,但目前首選風險降低藥物。(2)BRCA1/2突變攜帶者、有<30歲胸部RT史者乳腺癌風險非常高,建議考慮RRM。(3)對于風險評估模型提示乳腺癌風險升高者,改良Gail模型5年風險≥1.7%時可以考慮使用降低風險藥物,但至少Gail模型5年風險≥3%或IBIS/Tyrer-Cuzick模型10年風險≥5%時才推薦使用。
對于愿意接受風險降低治療的個體,首先進行乳腺的基線評估,如不能提供既往的乳腺評估資料,則根據《NCCN乳腺癌篩查和診斷指南》[123]進行乳腺篩查。基線評估如發現異常,則按照指南[123]進行處理;如未發現異常,即可進一步選擇合適的風險降低處理。對于符合風險降低手術標準的個體,應進一步討論手術選擇,愿意接受手術者進行相應手術;對于不符合手術標準或不愿接受手術的個體,<35歲者暫不推薦使用風險降低藥物,≥35歲者應根據絕經狀態和多系統基線評估推薦合適的風險降低藥物。
4.3 風險降低藥物治療的管理
4.3.1 藥物治療前的評估
首先評估患者的絕經狀態,絕經這一概念用于乳腺癌管理主要指卵巢雌激素合成的長期和永久下降。本指南推薦的絕經標準包括:(1)雙側卵巢切除術后;(2)年齡≥60歲;(3)年齡<60歲者未使用化療、他莫昔芬、托瑞米芬的情況下停經≥12 個月;(4)處于卵巢功能抑制狀態且卵泡刺激素(follicle-stimulating hormone,FSH)和雌二醇在絕經后范圍內;(5)年齡<60歲者服用他莫昔芬或托瑞米芬的情況下FSH和血漿雌二醇水平在絕經后范圍內。
而后進行用藥前的多系統基線評估:(1)有完整子宮者需行基線婦科評估,確保在開始治療前沒有需要評估的異常陰道流血;(2)絕經后個體需評估基線BMD,指導藥物選擇;(3)是否有血栓病史或血栓高風險;(4)是否有白內障病史或白內障高風險。
4.3.2 風險降低藥物的選擇及管理
對于絕經前高危人群,他莫昔芬是唯一可用的風險降低藥物,在這類人群中他莫昔芬沒有明顯增加子宮內膜癌的風險[91-92],此時他莫昔芬的風險/獲益比也相對有利。
對于絕經后高危人群,根據基線評估結果可選擇他莫昔芬、雷洛昔芬、依西美坦或阿那曲唑。用藥早期雷洛昔芬與他莫昔芬療效相同,長期隨訪發現他莫昔芬獲益(特別是停藥后的獲益)更大[100],但還沒有數據比較依西美坦或阿那曲唑(AIs)與他莫昔芬或雷洛昔芬的獲益和風險。本指南認為,對大多數絕經后患者來說,他莫昔芬是最佳選擇,但需結合子宮存在情況及合并癥進行個體化選擇:(1)考慮到他莫昔芬對子宮內膜的刺激,有子宮者更可能首選雷洛昔芬;(2)考慮到他莫昔芬會增加白內障風險,有白內障風險的患者也可能首選雷洛昔芬;(3)考慮到AIs會增加骨量減少/骨質疏松風險,基線評估BMD低者首選雷洛昔芬;(4)考慮到血栓風險,有血栓病史者或血栓風險高者禁用他莫昔芬或雷洛昔芬,更可能選擇AIs;(5)考慮到致畸風險,妊娠或可能妊娠者禁用他莫昔芬和雷洛昔芬。
對于BRCA1/2或其他致病突變攜帶者,現有數據較少。對于BRCA1/2攜帶者,有數據顯示他莫昔芬用于BRCA2攜帶者可能有獲益;僅有回顧性數據表明,攜帶BRCA1/2突變的雌激素受體(estrogen receptor,ER)陽性乳腺癌患者使用AIs進行輔助治療能降低對側乳腺癌風險。而對于PTEN突變攜帶者,考慮到該突變所致的Cowden綜合征與子宮內膜癌風險增加相關,應慎用他莫昔芬,且使用時需溝通子宮內膜癌的風險問題。
4.3.3 藥物治療期間及結束后的管理
使用風險降低藥物期間應注重嚴重并發癥的監測:(1)有完整子宮者使用他莫昔芬時應進行常規適齡婦科篩查[《中國抗癌協會乳腺癌診治指南與規范(2021年版)》[115]建議使用婦科體格檢查結合子宮超聲檢查來共同評估];(2)使用AIs者應進行BMD監測;(3)使用SERMs者如出現血栓栓塞性疾病的相關癥狀應及時就診;(4)使用他莫昔芬者如有白內障或其他視力問題應進行眼科檢查等。此外,使用他莫昔芬者在完成5年療程后,應繼續監測后期毒性,尤其是子宮內膜癌和白內障。在治療過程中和治療結束后,如出現不良反應均應及時進行處理。
4.4 風險降低手術治療的管理
4.4.1 風險降低手術前后的管理
對于符合RRM手術指征、擬行RRM 的乳腺癌高危人群,應及早溝通并持續關注由于乳腺切除帶來的潛在社會心理影響[124],包括對自我身體形象的認同感、新建人際關系的難度以及現有人際關系的質量等帶來的負面影響,必要時進行心理咨詢。本指南建議:擬行RRM術前應進行多學科會診(應包括熟悉良惡性乳腺疾病自然病程和治療的外科醫生)[125],使個體充分了解降低乳腺癌風險可選治療方式、RRM的風險與獲益、保留乳頭的選擇以及乳房重建的選擇等。
對于考慮RRSO的BRCA1/2突變攜帶者,應充分溝通術中和術后的潛在風險,并積極地進行術后管理,包括但不限于:(1)手術本身相關的并發癥;(2)過早絕經相關的骨質疏松癥和心血管疾病風險增加;(3)圍絕經期癥狀,如骨質流失加速、血管舒縮癥狀、可能的認知變化等對生活質量的潛在影響。HRT能改善RRSO術后過早絕經相關的困擾,但是否會再次增加乳腺癌風險還存在爭議。如前所述,絕經后女性使用HRT可能會增加乳腺癌風險(詳見1.2.3)[46-49];然而,也有研究[126]顯示,RRSO術后短期使用任何類型HRT(包括單用雌激素、孕激素±雌激素等)都不會影響RRSO相關的乳腺癌風險降低。對此,NCCN專家組的共識是易感基因P/LP突變攜帶者RRSO術后仍應慎用HRT。
4.4.2 風險降低手術的選擇
除乳腺癌和卵巢癌風險均高的易感基因P/LP突變(如BRCA1/2等)攜帶者可能會考慮RRSO以外,其他考慮通過手術預防乳腺癌的高危人群通常建議選擇RRM。而對于BRCA1/2突變攜帶者,有Monte Carlo模擬模型(詳見指南中表2)分別評估了BRCA1或BRCA2突變攜帶者在不同年齡接受RRM和(或)RRSO后70歲時的生存概率[127]。從該模型的評估結果來看, BRCA1/2突變攜帶者單獨接受RRSO或RRM都能提升70歲時的生存概率(60%~70%),若RRSO配合RRM或乳腺篩查更能大幅提升70歲時生存概率(70%~80%)[127]。指南認為,BRCA1/2突變攜帶者選擇RRSO和(或)RRM時,可使用上述模型輔助決策,但仍主要取決于患者個人看法[128]。
5 總結
目前,我國乳腺癌高危人群的評估和錨定尚缺乏切實可行的系統性策略和辦法,更多地依賴于個體自主的機會性篩查,接受規范的風險降低管理更是尚無良方,多數高危人群并沒有獲得合適的降低風險的指導和管理,更談不上接受恰當的風險降低治療。本文對《NCCN乳腺癌風險降低指南(2023年版)》進行解讀,結合亞洲女性的乳腺特點以及我國乳腺癌的疾病現狀,將乳腺癌風險評估和風險降低管理過程進行歸納整理,探討了適合我國人群的乳腺癌風險降低管理流程,旨在為我國乳腺癌高危人群健康管理提供更科學準確的風險管理參考。我們建議:全社會積極宣傳乳腺癌風險主動管理的重要性,鼓勵高危人群定期篩查,并在專業醫生指導下接受必要的降低風險治療;提倡健康的生活方式,注重不良環境因素對乳腺癌發病的潛在影響,尤其是4個敏感窗口期的乳腺癌風險防控管理;同時,提高各級醫療機構從業人員對乳腺癌風險評估和管理的認識水平,利用新興的科技手段提升乳腺疾病群體篩查的同質化水平和質效,從而降低乳腺癌的發病率,促進“健康中國2030”的實現。
利益沖突:無。
作者貢獻:郭心怡進行文獻檢索和閱讀,論文撰寫和修改,圖表繪制,并對文章負責;呂青指導論文撰寫與修改,進行質量控制及審校。