引用本文: 劉詩亮, 沈吟, 陳媛媛, 胡單萍, 田凱琳, 陳長征, 邢怡橋. 新型Micron Ⅳ視網膜影像系統在三種小鼠疾病模型中的應用. 中華眼底病雜志, 2014, 30(3): 294-298. doi: 10.3760/cma.j.issn.1005-1015.2014.03.016 復制
目前,臨床上開展各項影像和功能檢查平臺已經日趨成熟。然而,動物眼科研究工具的開發略顯滯后。小動物眼球極小,且與人眼比較存在屈光系數不同。所以,用于人眼的影像和功能檢查儀器難于捕捉到清晰的小鼠眼底血管形態圖像以及電生理數據。從最初的視網膜成像顯微鏡開始,Micron技術不斷開發創新的動物眼科研究工具,整合成為成熟的實驗室一體化研究平臺。本研究采用最新的Micron Ⅳ全功能小動物視網膜活體影像系統,利用明場視網膜成像、熒光素眼底血管造影(FFA)、光相干斷層掃描(OCT)以及視網膜電圖(ERG)等技術對氧誘導視網膜病變(OIR)、N-甲基-N-亞硝脲(MNU)致視網膜光感受器細胞變性、N-甲基-D-天冬氨酸(NMDA)誘導的視網膜神經節細胞(RGC)急性損傷3種不同的疾病模型小鼠進行檢查,分析評價其應用效果。現將結果報道如下。
1 材料和方法
健康雄性C57BL/6J小鼠24只。其中,7日齡6只; 6周齡15只;12月齡3只。清潔級。武漢大學實驗動物中心提供。動物飼養和使用遵照實驗動物使用的有關規定。
采用拋硬幣法將7日齡小鼠隨機分為正常對照組和OIR模型組,每組3只小鼠。參照文獻[1]的方法建立OIR模型,將小鼠與哺乳母鼠放于自制的密閉氧箱內,控制氧箱內氧氣流量在0.5~1.0 L/min,溫度維持在25 ℃左右,用測氧儀(CY-12C型,建德市梅城電化分析儀器廠)持續監測氧濃度為(75±2)%。每天觀察其生長情況并交替將哺乳母鼠置于正常環境中觀察6~8 h后再放回氧箱。小鼠連續吸高濃度氧飼養5 d后,再置于正常氧環境中飼養5 d。正常對照組小鼠置于正常環境溫度下飼養至17日齡。
6周齡C57BL/6J小鼠6只,采用拋硬幣法隨機分為對照組和MNU模型組,每組3只小鼠。新鮮無菌生理鹽水配制1%的MNU(美國Sigma公司),工作液含有0.05%醋酸,避光4 ℃保存。參照文獻[2]的方法按體重60 mg/kg的劑量一次腹腔注射建立MNU模型。對照組小鼠腹腔注射等體積生理鹽水。
6周齡C57BL/6J小鼠6只,右眼參照文獻[3]的方法并適當改進建立NMDA模型(NMDA模型組)。小鼠全身麻醉后,眼表10%碘酊消毒。手術顯微鏡下,于顳側角鞏膜緣1 mm處用32G針頭刺穿,10 μl微量注射器(美國Hamilton公司)注入濃度為10 mmol/L的NMDA(美國Sigma公司) 3 μl,手術結束時結膜囊內涂紅霉素眼膏預防感染。左眼(對照組)玻璃體腔注射相同體積的磷酸鹽緩沖液。
應用Micron Ⅳ視網膜影像系統(美國Phoenix Research Labs公司)對17日齡、6周齡、12月齡小鼠,OIR模型組、MNU模型組、NMDA模型組小鼠行眼底彩色照相檢查;17日齡、6周齡、12月齡小鼠,OIR模型組、MNU模型組小鼠行FFA檢查;17日齡、6周齡、12月齡小鼠,OIR模型組、MNU模型組小鼠行OCT檢查;17日齡、6周齡、12月齡小鼠,MNU模型組建模后1、2、3 d和對照組小鼠,NMDA模型組建模后12、24 h和對照組小鼠行ERG檢查。
檢查時,小鼠擱置于設備配套的小動物臺上,全身麻醉后剪去鼠須,復方托吡卡胺滴眼液散瞳,并在整個操作過程中用羥丙甲纖維素滴眼液濕潤角膜,保證屈光間質透明。眼底彩色照相時,小鼠暴露鼠眼并調整鏡頭方向,直至視網膜目標血管在屏幕清晰可見,在統一的測量參數下拍攝彩色眼底像。OCT檢查時,在可視化的明場下,對眼底進行線性水平掃描,10 000 ~ 20 000 A掃描/s,調節接收器增益,經降噪平均后獲取OCT圖像,橫向、縱向分辨率均為2 μm。FFA檢查時,按體重0.001 ml/g劑量腹腔注射10%熒光素鈉(美國Alcon公司),1 s內注射完畢。從注射開始計時,攝像機拍攝設置為4幀/s,直至5 min,以后間隔10 min進行1次眼底照相,直至熒光消失。ERG檢查時,小鼠暗適應24 h后,于暗室內弱紅光照明下進行操作。全身麻醉后,將參考電極和接地電極分別插入到兩耳之間和尾根部皮下,用眼科粘彈劑涂抹眼球表面保護角膜和降低干擾,移動金屬試驗臺后微調,使角膜和金屬環形記錄電極接觸,金屬試驗臺與放大器接地線。通過強度為80 Hz的單色光(綠光)刺激閃光模式,間隔10 s進行一次數據采集。同一眼連續測定5次,記錄并打印圖形。
采用SPSS 13.0統計軟件行統計學分析處理。實驗數據以均數±標準差(
2 結果
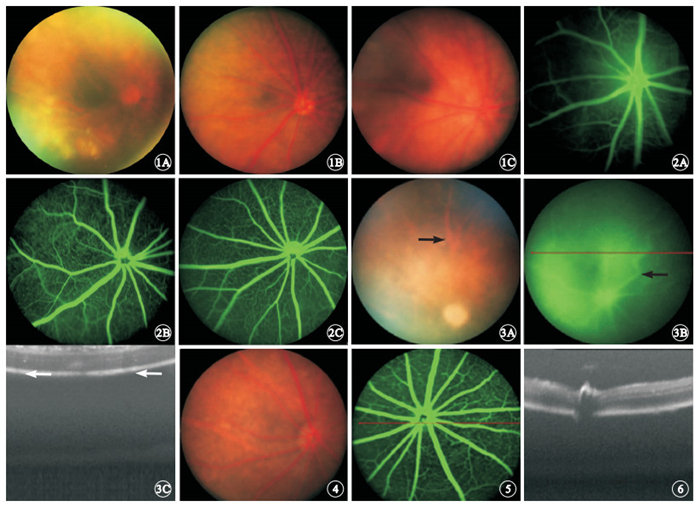
不同年齡段正常小鼠視網膜結構均清晰,視盤位于眼球后部中央,沿視盤發出1只細且直的動脈,伴行8只較粗的視網膜靜脈,未見黃斑樣結構,無滲出和出血(圖 1)。FFA檢查結果顯示,3~8 s可見視網膜動脈顯影,9~20 s后圖像清晰,可見眼底1級血管充盈顯影;21 s~5 min后可見稀疏的小動脈分支形成的淺層毛細血管網;小靜脈匯集成的視網膜靜脈;視網膜小血管最小到4級血管均可顯像;5 min后背景熒光逐漸變亮,眼底血管走形和輪廓清晰程度能夠持續到2 h。顯示視網膜血管分布均勻,走行自然。深淺兩層血管網清晰可見,深層血管呈多邊形網狀結構,淺層血管呈放射狀分布(圖 2)。OCT檢查可觀察到明顯的視網膜分層且結構分明,ERG波形穩定。
OIR 模型組小鼠視網膜血管高度擴張、紆曲,走形僵直,隱約可見暗紅色血管網(圖 3A)。FFA檢查可見后極部無血管灌注區,中周部形態異常、分布紊亂的新生血管叢,熒光滲漏致玻璃體腔混濁(圖 3B)。OCT檢查可見視網膜前纖維血管組織及紆曲擴張血管后方粗大的陰影暗區(圖 3C)。
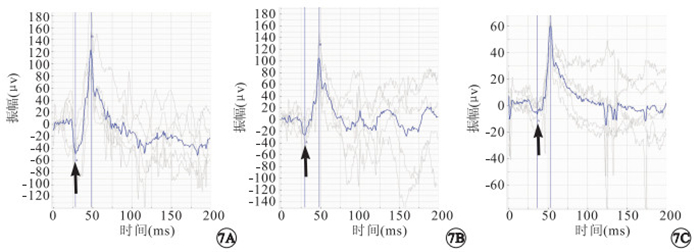
MNU 模型組小鼠視盤呈蠟黃色萎縮,視網膜顏色灰暗但無明顯色素性改變(圖 4)。FFA檢查可見視網膜血管輕微變細,無明顯熒光強度或分布的異常(圖 5)。OCT檢查可見視網膜厚度正常,結構變化不明顯(圖 6)。ERG檢查結果顯示,正常對照組小鼠a、b波潛伏期分別為(28.05±4.08)、(47.35±6.72) ms,最大混合反應a波振幅為(51.88±3.66) μV。MNU模型組小鼠建模后1、2、3 d,a波潛伏期分別為(28.16±3.41)、(29.67±2.60)、(32.90±4.27) ms,b波潛伏期分別為(48.35±4.17)、(47.71±4.35)、(53.02±5.09) ms。a、b波潛伏期變化不明顯(圖 7)。建模后1、2、3 d,最大混合反應a波振幅分別為(48.87±4.43)、(15.38±4.36)、(13.78±5.52) μV。建模后2、3 d,最大混合反應a波振幅明顯下降,下降幅度與建模時間呈正比。建模后2、3 d最大混合反應a波振幅分別與正常組小鼠比較,差異有統計學意義(t=7.650、32.000,P<0.01)。
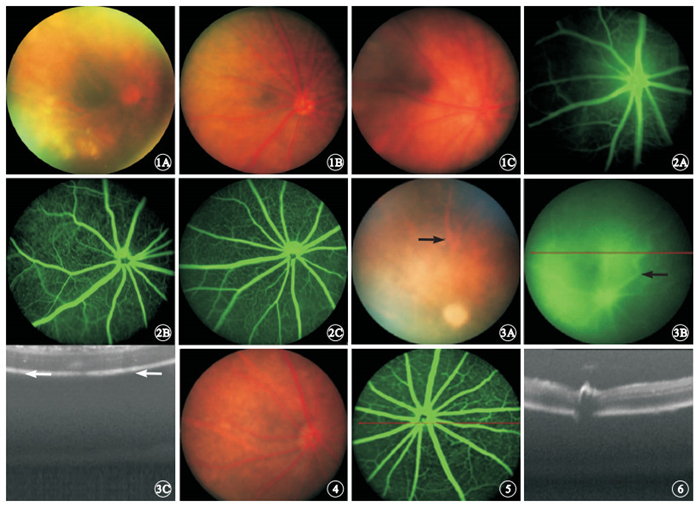 圖1
正常小鼠右眼彩色眼底像。1A~1C.分別為正常對照組,6周齡、12月齡小鼠彩色眼底像。視網膜結構清晰,視盤位于眼球后部中央,沿視盤發出1只細且直的動脈,伴行8只較粗的視網膜靜脈,未見黃斑樣結構,無滲出和出血 ? ?圖 2 正常小鼠右眼FFA像。2A~2C.分別正常對照組,6周齡、12個月齡小鼠FFA像。視網膜結構清晰,血管行徑正常,熒光充盈均勻,無滲漏 ? ?圖 3 OIR模型小鼠彩色眼底像、FFA像、水平掃描OCT像。3A.彩色眼底像,視網膜血管高度擴張、紆曲,走形僵直(黑箭);3B.FFA像,可見形態異常、分布紊亂的新生血管叢(黑箭),熒光滲漏致玻璃體腔混濁;3C.OCT像,視網膜前纖維血管組織及紆曲擴張血管后方粗大的陰影暗區(白箭) ? ?圖 4 MNU模型組小鼠彩色眼底像。視盤呈蠟黃色萎縮 ? ?圖 5 MNU模型組小鼠FFA像。視網膜血管輕微變細 ? ?圖 6 MNU模型組小鼠OCT像。視網膜厚度和結構未見改變
圖1
正常小鼠右眼彩色眼底像。1A~1C.分別為正常對照組,6周齡、12月齡小鼠彩色眼底像。視網膜結構清晰,視盤位于眼球后部中央,沿視盤發出1只細且直的動脈,伴行8只較粗的視網膜靜脈,未見黃斑樣結構,無滲出和出血 ? ?圖 2 正常小鼠右眼FFA像。2A~2C.分別正常對照組,6周齡、12個月齡小鼠FFA像。視網膜結構清晰,血管行徑正常,熒光充盈均勻,無滲漏 ? ?圖 3 OIR模型小鼠彩色眼底像、FFA像、水平掃描OCT像。3A.彩色眼底像,視網膜血管高度擴張、紆曲,走形僵直(黑箭);3B.FFA像,可見形態異常、分布紊亂的新生血管叢(黑箭),熒光滲漏致玻璃體腔混濁;3C.OCT像,視網膜前纖維血管組織及紆曲擴張血管后方粗大的陰影暗區(白箭) ? ?圖 4 MNU模型組小鼠彩色眼底像。視盤呈蠟黃色萎縮 ? ?圖 5 MNU模型組小鼠FFA像。視網膜血管輕微變細 ? ?圖 6 MNU模型組小鼠OCT像。視網膜厚度和結構未見改變
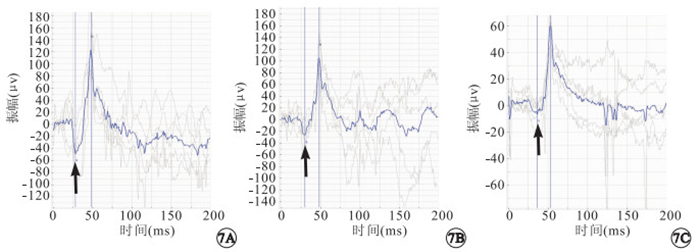 圖7
MNU模型組小鼠建模后ERG像。7A~7C.分別為建模后1、2、3 d。a、b波潛伏期變化不大;建模后2、3 d最大混合反應a波振幅明顯下降(黑箭)
圖7
MNU模型組小鼠建模后ERG像。7A~7C.分別為建模后1、2、3 d。a、b波潛伏期變化不大;建模后2、3 d最大混合反應a波振幅明顯下降(黑箭)
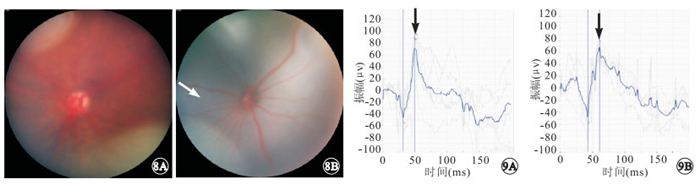
NMDA模型組小鼠視網膜呈蒼白色改變,血管痙攣紆曲(圖 8)。ERG檢查結果顯示,NMDA模型組小鼠建模后12、24 h,a波潛伏期分別為(31.84±5.70)、(38.71±6.62) ms,b波潛伏期分別為(44.29±4.62)、(54.86±7.53) ms。a、b波潛伏期變化不明顯。正常對照組小鼠最大混合反應b波振幅為(144.40±15.76) μV。NMDA模型組小鼠建模后12、24 h,最大混合反應b波振幅分別為(72.28±7.18)、(65.35±9.18) μV。NMDA模型組小鼠最大混合反應b波振幅明顯下降(圖 9),與對照組小鼠最大混合反應b波振幅比較,差異有統計學意義(t=5.123、5.992,P<0.05)。
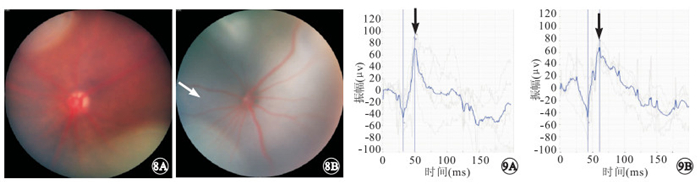 圖8
NMDA模型組小鼠彩色眼底像。8A、8B分別為建模后12、24 h,視網膜呈蒼白色改變,血管痙攣紆曲(白箭) ? ?圖 9 NMDA模型組小鼠 ERG像。9A、9B分別為建模后12、24 h。最大混合反應b波振幅下降較為明顯(黑箭)
圖8
NMDA模型組小鼠彩色眼底像。8A、8B分別為建模后12、24 h,視網膜呈蒼白色改變,血管痙攣紆曲(白箭) ? ?圖 9 NMDA模型組小鼠 ERG像。9A、9B分別為建模后12、24 h。最大混合反應b波振幅下降較為明顯(黑箭)
3 討論
眼底疾病種類多樣,許多發病機制不明,缺乏有效的治療方法。因此,建立相應的動物模型對揭示各種眼底疾病的發病機制,探討疾病的診斷、治療及預防方法均具有重要意義。本研究應用最新的Micron Ⅳ視網膜影像系統,利用眼底彩色照相、FFA、OCT以及ERG技術對3種常用且具有代表性的小鼠眼科疾病模型進行了無創、實時的分析及評價。探索Micron Ⅳ技術平臺在眼科基礎研究中的應用價值,以期為今后的研究提供新的思路和手段。
OIR小鼠模型是一種常用的視網膜新生血管模型[1, 4]。既往視網膜新生血管的多少主要通過病理學切片或視網膜鋪片中血管造影染色來判斷[5]。本研究應用Micron Ⅳ在活體水平上對其進行觀察,發現模型組與對照組在視網膜血管形態結構上存在顯著差異。整個實驗操作過程簡單、快捷,圖像清晰可靠。證實Micron Ⅳ為眼科研究中動態、持續獲取同一動物的活體視網膜影像數據創造了條件。
作為一種烷基化衍生物,MNU可以誘導多種動物視網膜變性[6, 7],且單次腹腔給藥能在1周內造成嚴重的光感受器細胞損害。導致ERG中起源于視網膜光感受器和色素上皮細胞的a波振幅明顯下降,本研究ERG檢查結果與既往的文獻報道結果一致[8]。且實驗結果表明,電生理功能檢查比形態學改變更加敏感。進一步證實Micron Ⅳ可實現小動物視網膜功能的精確測量,靈活設定刺激光波長、能量、閃頻和脈沖寬度等。
RGC凋亡常見于青光眼和視網膜動脈阻塞等多種視網膜的神經退行性疾病[9]。玻璃體腔注射的NMDA可通過激活視網膜細胞膜上NMDA型谷氨酸受體,導致大量的鈣離子內流,隨后激活凋亡前信號級聯反應,導致神經元的興奮性毒性損傷[10]。本研究提供了玻璃體腔注射NMDA誘導的急性RGC興奮毒性損傷在小鼠模型上的建立方法,并進一步利用Micron Ⅳ觀察了造模后的結構和功能損傷。結果顯示,NMDA模型組小鼠b波波幅出現明顯下降。由于b波起源于視網膜內層,與視網膜雙極細胞有關。 因此,我們推測可能的原因是雙極細胞作為神經節細胞的上游神經元也受到一定的損傷,導致b波振幅的下降。
Micron設備是專為小型實驗動物眼球成像而開發的高技術眼科學研究綜合平臺系統,檢查結果被公認為小動物視網膜影像的新標準[11, 12]。其優點在于:(1)上手操作快,無需特殊的實驗準備。(2)采用專為小動物設計的視網膜影像擷取系統,更易尋找和觀察病變區域。(3)配備小動物操作臺可避免人為干擾,結果更穩定。(4)Micron Ⅳ在基本系統平臺上可以快速擴展其他功能,此類模式具有重要應用價值。最新一代Micron Ⅳ平臺在之前的基礎上配備多項擴展功能,覆蓋了眼球形態學、功能研究以及激光注入研究等。可選模塊包括視網膜顯微成像系統、激光注射引導及激光器、高分辨率OCT、裂隙燈成像系統和電生理ERG等。能更加方便清晰地獲得小鼠的眼底彩色像和FFA、OCT、ERG圖像,為眼科實驗動物造模及指標檢測提供了極大的便利。此外,Micron Ⅳ可選擇多種濾光片或近紅外接收系統,提供普通明場、熒光素、伊凡思藍血管造影以及熒光圖像4種成像方式。最先進的的低噪音三芯片CCD相機作為一種高靈敏度感應器,可以捕捉很微弱的熒光,血管細節也呈現出清晰的圖像。但其不足之處是價格相對昂貴,不具備同時顯影脈絡膜血管的技術特點,OCT圖像的分辨率有待進一步提高,軟件功能不夠強大等。另外為做到ERG波形穩定,實驗過程中應保證小動物眼球與檢測設備接觸良好。每個實驗室應該建立自己的電生理數據標準值,才能分析得到可靠結果。
目前,臨床上開展各項影像和功能檢查平臺已經日趨成熟。然而,動物眼科研究工具的開發略顯滯后。小動物眼球極小,且與人眼比較存在屈光系數不同。所以,用于人眼的影像和功能檢查儀器難于捕捉到清晰的小鼠眼底血管形態圖像以及電生理數據。從最初的視網膜成像顯微鏡開始,Micron技術不斷開發創新的動物眼科研究工具,整合成為成熟的實驗室一體化研究平臺。本研究采用最新的Micron Ⅳ全功能小動物視網膜活體影像系統,利用明場視網膜成像、熒光素眼底血管造影(FFA)、光相干斷層掃描(OCT)以及視網膜電圖(ERG)等技術對氧誘導視網膜病變(OIR)、N-甲基-N-亞硝脲(MNU)致視網膜光感受器細胞變性、N-甲基-D-天冬氨酸(NMDA)誘導的視網膜神經節細胞(RGC)急性損傷3種不同的疾病模型小鼠進行檢查,分析評價其應用效果。現將結果報道如下。
1 材料和方法
健康雄性C57BL/6J小鼠24只。其中,7日齡6只; 6周齡15只;12月齡3只。清潔級。武漢大學實驗動物中心提供。動物飼養和使用遵照實驗動物使用的有關規定。
采用拋硬幣法將7日齡小鼠隨機分為正常對照組和OIR模型組,每組3只小鼠。參照文獻[1]的方法建立OIR模型,將小鼠與哺乳母鼠放于自制的密閉氧箱內,控制氧箱內氧氣流量在0.5~1.0 L/min,溫度維持在25 ℃左右,用測氧儀(CY-12C型,建德市梅城電化分析儀器廠)持續監測氧濃度為(75±2)%。每天觀察其生長情況并交替將哺乳母鼠置于正常環境中觀察6~8 h后再放回氧箱。小鼠連續吸高濃度氧飼養5 d后,再置于正常氧環境中飼養5 d。正常對照組小鼠置于正常環境溫度下飼養至17日齡。
6周齡C57BL/6J小鼠6只,采用拋硬幣法隨機分為對照組和MNU模型組,每組3只小鼠。新鮮無菌生理鹽水配制1%的MNU(美國Sigma公司),工作液含有0.05%醋酸,避光4 ℃保存。參照文獻[2]的方法按體重60 mg/kg的劑量一次腹腔注射建立MNU模型。對照組小鼠腹腔注射等體積生理鹽水。
6周齡C57BL/6J小鼠6只,右眼參照文獻[3]的方法并適當改進建立NMDA模型(NMDA模型組)。小鼠全身麻醉后,眼表10%碘酊消毒。手術顯微鏡下,于顳側角鞏膜緣1 mm處用32G針頭刺穿,10 μl微量注射器(美國Hamilton公司)注入濃度為10 mmol/L的NMDA(美國Sigma公司) 3 μl,手術結束時結膜囊內涂紅霉素眼膏預防感染。左眼(對照組)玻璃體腔注射相同體積的磷酸鹽緩沖液。
應用Micron Ⅳ視網膜影像系統(美國Phoenix Research Labs公司)對17日齡、6周齡、12月齡小鼠,OIR模型組、MNU模型組、NMDA模型組小鼠行眼底彩色照相檢查;17日齡、6周齡、12月齡小鼠,OIR模型組、MNU模型組小鼠行FFA檢查;17日齡、6周齡、12月齡小鼠,OIR模型組、MNU模型組小鼠行OCT檢查;17日齡、6周齡、12月齡小鼠,MNU模型組建模后1、2、3 d和對照組小鼠,NMDA模型組建模后12、24 h和對照組小鼠行ERG檢查。
檢查時,小鼠擱置于設備配套的小動物臺上,全身麻醉后剪去鼠須,復方托吡卡胺滴眼液散瞳,并在整個操作過程中用羥丙甲纖維素滴眼液濕潤角膜,保證屈光間質透明。眼底彩色照相時,小鼠暴露鼠眼并調整鏡頭方向,直至視網膜目標血管在屏幕清晰可見,在統一的測量參數下拍攝彩色眼底像。OCT檢查時,在可視化的明場下,對眼底進行線性水平掃描,10 000 ~ 20 000 A掃描/s,調節接收器增益,經降噪平均后獲取OCT圖像,橫向、縱向分辨率均為2 μm。FFA檢查時,按體重0.001 ml/g劑量腹腔注射10%熒光素鈉(美國Alcon公司),1 s內注射完畢。從注射開始計時,攝像機拍攝設置為4幀/s,直至5 min,以后間隔10 min進行1次眼底照相,直至熒光消失。ERG檢查時,小鼠暗適應24 h后,于暗室內弱紅光照明下進行操作。全身麻醉后,將參考電極和接地電極分別插入到兩耳之間和尾根部皮下,用眼科粘彈劑涂抹眼球表面保護角膜和降低干擾,移動金屬試驗臺后微調,使角膜和金屬環形記錄電極接觸,金屬試驗臺與放大器接地線。通過強度為80 Hz的單色光(綠光)刺激閃光模式,間隔10 s進行一次數據采集。同一眼連續測定5次,記錄并打印圖形。
采用SPSS 13.0統計軟件行統計學分析處理。實驗數據以均數±標準差(
2 結果
不同年齡段正常小鼠視網膜結構均清晰,視盤位于眼球后部中央,沿視盤發出1只細且直的動脈,伴行8只較粗的視網膜靜脈,未見黃斑樣結構,無滲出和出血(圖 1)。FFA檢查結果顯示,3~8 s可見視網膜動脈顯影,9~20 s后圖像清晰,可見眼底1級血管充盈顯影;21 s~5 min后可見稀疏的小動脈分支形成的淺層毛細血管網;小靜脈匯集成的視網膜靜脈;視網膜小血管最小到4級血管均可顯像;5 min后背景熒光逐漸變亮,眼底血管走形和輪廓清晰程度能夠持續到2 h。顯示視網膜血管分布均勻,走行自然。深淺兩層血管網清晰可見,深層血管呈多邊形網狀結構,淺層血管呈放射狀分布(圖 2)。OCT檢查可觀察到明顯的視網膜分層且結構分明,ERG波形穩定。
OIR 模型組小鼠視網膜血管高度擴張、紆曲,走形僵直,隱約可見暗紅色血管網(圖 3A)。FFA檢查可見后極部無血管灌注區,中周部形態異常、分布紊亂的新生血管叢,熒光滲漏致玻璃體腔混濁(圖 3B)。OCT檢查可見視網膜前纖維血管組織及紆曲擴張血管后方粗大的陰影暗區(圖 3C)。
MNU 模型組小鼠視盤呈蠟黃色萎縮,視網膜顏色灰暗但無明顯色素性改變(圖 4)。FFA檢查可見視網膜血管輕微變細,無明顯熒光強度或分布的異常(圖 5)。OCT檢查可見視網膜厚度正常,結構變化不明顯(圖 6)。ERG檢查結果顯示,正常對照組小鼠a、b波潛伏期分別為(28.05±4.08)、(47.35±6.72) ms,最大混合反應a波振幅為(51.88±3.66) μV。MNU模型組小鼠建模后1、2、3 d,a波潛伏期分別為(28.16±3.41)、(29.67±2.60)、(32.90±4.27) ms,b波潛伏期分別為(48.35±4.17)、(47.71±4.35)、(53.02±5.09) ms。a、b波潛伏期變化不明顯(圖 7)。建模后1、2、3 d,最大混合反應a波振幅分別為(48.87±4.43)、(15.38±4.36)、(13.78±5.52) μV。建模后2、3 d,最大混合反應a波振幅明顯下降,下降幅度與建模時間呈正比。建模后2、3 d最大混合反應a波振幅分別與正常組小鼠比較,差異有統計學意義(t=7.650、32.000,P<0.01)。
 圖1
正常小鼠右眼彩色眼底像。1A~1C.分別為正常對照組,6周齡、12月齡小鼠彩色眼底像。視網膜結構清晰,視盤位于眼球后部中央,沿視盤發出1只細且直的動脈,伴行8只較粗的視網膜靜脈,未見黃斑樣結構,無滲出和出血 ? ?圖 2 正常小鼠右眼FFA像。2A~2C.分別正常對照組,6周齡、12個月齡小鼠FFA像。視網膜結構清晰,血管行徑正常,熒光充盈均勻,無滲漏 ? ?圖 3 OIR模型小鼠彩色眼底像、FFA像、水平掃描OCT像。3A.彩色眼底像,視網膜血管高度擴張、紆曲,走形僵直(黑箭);3B.FFA像,可見形態異常、分布紊亂的新生血管叢(黑箭),熒光滲漏致玻璃體腔混濁;3C.OCT像,視網膜前纖維血管組織及紆曲擴張血管后方粗大的陰影暗區(白箭) ? ?圖 4 MNU模型組小鼠彩色眼底像。視盤呈蠟黃色萎縮 ? ?圖 5 MNU模型組小鼠FFA像。視網膜血管輕微變細 ? ?圖 6 MNU模型組小鼠OCT像。視網膜厚度和結構未見改變
圖1
正常小鼠右眼彩色眼底像。1A~1C.分別為正常對照組,6周齡、12月齡小鼠彩色眼底像。視網膜結構清晰,視盤位于眼球后部中央,沿視盤發出1只細且直的動脈,伴行8只較粗的視網膜靜脈,未見黃斑樣結構,無滲出和出血 ? ?圖 2 正常小鼠右眼FFA像。2A~2C.分別正常對照組,6周齡、12個月齡小鼠FFA像。視網膜結構清晰,血管行徑正常,熒光充盈均勻,無滲漏 ? ?圖 3 OIR模型小鼠彩色眼底像、FFA像、水平掃描OCT像。3A.彩色眼底像,視網膜血管高度擴張、紆曲,走形僵直(黑箭);3B.FFA像,可見形態異常、分布紊亂的新生血管叢(黑箭),熒光滲漏致玻璃體腔混濁;3C.OCT像,視網膜前纖維血管組織及紆曲擴張血管后方粗大的陰影暗區(白箭) ? ?圖 4 MNU模型組小鼠彩色眼底像。視盤呈蠟黃色萎縮 ? ?圖 5 MNU模型組小鼠FFA像。視網膜血管輕微變細 ? ?圖 6 MNU模型組小鼠OCT像。視網膜厚度和結構未見改變
 圖7
MNU模型組小鼠建模后ERG像。7A~7C.分別為建模后1、2、3 d。a、b波潛伏期變化不大;建模后2、3 d最大混合反應a波振幅明顯下降(黑箭)
圖7
MNU模型組小鼠建模后ERG像。7A~7C.分別為建模后1、2、3 d。a、b波潛伏期變化不大;建模后2、3 d最大混合反應a波振幅明顯下降(黑箭)
NMDA模型組小鼠視網膜呈蒼白色改變,血管痙攣紆曲(圖 8)。ERG檢查結果顯示,NMDA模型組小鼠建模后12、24 h,a波潛伏期分別為(31.84±5.70)、(38.71±6.62) ms,b波潛伏期分別為(44.29±4.62)、(54.86±7.53) ms。a、b波潛伏期變化不明顯。正常對照組小鼠最大混合反應b波振幅為(144.40±15.76) μV。NMDA模型組小鼠建模后12、24 h,最大混合反應b波振幅分別為(72.28±7.18)、(65.35±9.18) μV。NMDA模型組小鼠最大混合反應b波振幅明顯下降(圖 9),與對照組小鼠最大混合反應b波振幅比較,差異有統計學意義(t=5.123、5.992,P<0.05)。
 圖8
NMDA模型組小鼠彩色眼底像。8A、8B分別為建模后12、24 h,視網膜呈蒼白色改變,血管痙攣紆曲(白箭) ? ?圖 9 NMDA模型組小鼠 ERG像。9A、9B分別為建模后12、24 h。最大混合反應b波振幅下降較為明顯(黑箭)
圖8
NMDA模型組小鼠彩色眼底像。8A、8B分別為建模后12、24 h,視網膜呈蒼白色改變,血管痙攣紆曲(白箭) ? ?圖 9 NMDA模型組小鼠 ERG像。9A、9B分別為建模后12、24 h。最大混合反應b波振幅下降較為明顯(黑箭)
3 討論
眼底疾病種類多樣,許多發病機制不明,缺乏有效的治療方法。因此,建立相應的動物模型對揭示各種眼底疾病的發病機制,探討疾病的診斷、治療及預防方法均具有重要意義。本研究應用最新的Micron Ⅳ視網膜影像系統,利用眼底彩色照相、FFA、OCT以及ERG技術對3種常用且具有代表性的小鼠眼科疾病模型進行了無創、實時的分析及評價。探索Micron Ⅳ技術平臺在眼科基礎研究中的應用價值,以期為今后的研究提供新的思路和手段。
OIR小鼠模型是一種常用的視網膜新生血管模型[1, 4]。既往視網膜新生血管的多少主要通過病理學切片或視網膜鋪片中血管造影染色來判斷[5]。本研究應用Micron Ⅳ在活體水平上對其進行觀察,發現模型組與對照組在視網膜血管形態結構上存在顯著差異。整個實驗操作過程簡單、快捷,圖像清晰可靠。證實Micron Ⅳ為眼科研究中動態、持續獲取同一動物的活體視網膜影像數據創造了條件。
作為一種烷基化衍生物,MNU可以誘導多種動物視網膜變性[6, 7],且單次腹腔給藥能在1周內造成嚴重的光感受器細胞損害。導致ERG中起源于視網膜光感受器和色素上皮細胞的a波振幅明顯下降,本研究ERG檢查結果與既往的文獻報道結果一致[8]。且實驗結果表明,電生理功能檢查比形態學改變更加敏感。進一步證實Micron Ⅳ可實現小動物視網膜功能的精確測量,靈活設定刺激光波長、能量、閃頻和脈沖寬度等。
RGC凋亡常見于青光眼和視網膜動脈阻塞等多種視網膜的神經退行性疾病[9]。玻璃體腔注射的NMDA可通過激活視網膜細胞膜上NMDA型谷氨酸受體,導致大量的鈣離子內流,隨后激活凋亡前信號級聯反應,導致神經元的興奮性毒性損傷[10]。本研究提供了玻璃體腔注射NMDA誘導的急性RGC興奮毒性損傷在小鼠模型上的建立方法,并進一步利用Micron Ⅳ觀察了造模后的結構和功能損傷。結果顯示,NMDA模型組小鼠b波波幅出現明顯下降。由于b波起源于視網膜內層,與視網膜雙極細胞有關。 因此,我們推測可能的原因是雙極細胞作為神經節細胞的上游神經元也受到一定的損傷,導致b波振幅的下降。
Micron設備是專為小型實驗動物眼球成像而開發的高技術眼科學研究綜合平臺系統,檢查結果被公認為小動物視網膜影像的新標準[11, 12]。其優點在于:(1)上手操作快,無需特殊的實驗準備。(2)采用專為小動物設計的視網膜影像擷取系統,更易尋找和觀察病變區域。(3)配備小動物操作臺可避免人為干擾,結果更穩定。(4)Micron Ⅳ在基本系統平臺上可以快速擴展其他功能,此類模式具有重要應用價值。最新一代Micron Ⅳ平臺在之前的基礎上配備多項擴展功能,覆蓋了眼球形態學、功能研究以及激光注入研究等。可選模塊包括視網膜顯微成像系統、激光注射引導及激光器、高分辨率OCT、裂隙燈成像系統和電生理ERG等。能更加方便清晰地獲得小鼠的眼底彩色像和FFA、OCT、ERG圖像,為眼科實驗動物造模及指標檢測提供了極大的便利。此外,Micron Ⅳ可選擇多種濾光片或近紅外接收系統,提供普通明場、熒光素、伊凡思藍血管造影以及熒光圖像4種成像方式。最先進的的低噪音三芯片CCD相機作為一種高靈敏度感應器,可以捕捉很微弱的熒光,血管細節也呈現出清晰的圖像。但其不足之處是價格相對昂貴,不具備同時顯影脈絡膜血管的技術特點,OCT圖像的分辨率有待進一步提高,軟件功能不夠強大等。另外為做到ERG波形穩定,實驗過程中應保證小動物眼球與檢測設備接觸良好。每個實驗室應該建立自己的電生理數據標準值,才能分析得到可靠結果。